锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下: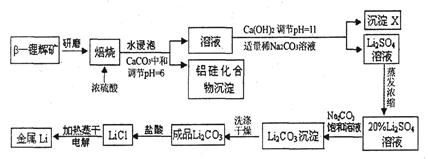
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了N a2CO3溶液,试说明前后浓度不同的原因:
a2CO3溶液,试说明前后浓度不同的原因:
____________________________________________________________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_____________________________________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是__________________________________________。
某烷烃发生氯代反应,其一氯代物只有一种。7.2g该烃进行氯代反应完全转化为一氯代物时,放出的气体可使500mlL 0.2mol/L的烧碱溶液恰好完全中和。计算该烃的分子式并写出结构简式。
实验室常用浓硫酸和乙醇混合加
 热制取乙烯。
热制取乙烯。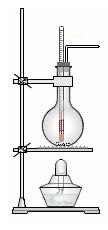
(1) 实验室制乙烯的化学方程式为。
(2)实验室用浓硫酸和乙醇混合加热制乙烯可用如上图所示装置,下列说法正确的是。
A.浓硫酸只作催化剂
B.在反应容器中放入几片碎瓷片防止混合液暴沸
C.反应温度缓慢上升至170℃
D.用排水法或向下排气法收集乙烯
E.园底烧瓶中装得是4mL乙醇和12mL3mol/L H2SO4混合液
F.温度计应 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度
G.反应完毕后先熄灭酒精灯,再从水中取出导管
(3)若将此装置中的温度计换成分液漏斗,则还可以制取的气体有(酒精灯 可用可不用)。
可用可不用)。
A.CO2B.NH3C.O2 D.SO2E.NO2F.Cl2
(4) 如温度过高,反应后溶液颜色变。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。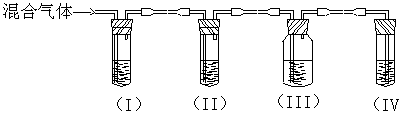
①I、II、III、IV装置可盛放的试剂是(请将下列有关试剂的序号填入空格内):
A、品红 B、NaOH溶液 C、浓硫酸D、酸性KMnO4溶液
I ;II;III;IV。
;II;III;IV。
②能说明SO2气体存在的现象是
③使用装置II的目的是;
④使用置III的目的是 ;
⑤确定含有乙烯的现象是。
某烃中碳、氢元素的质量比是24:5,该烃在标况下的密度是2.59g/L,则该烃的最简式是,摩尔质量是,分子式为。
某链烃的化学式为C6H4, 若分子中已有一个碳碳双键,则还含有碳碳叁键 个,某链烃的化学式为C200H200,则分子中最多含碳碳叁键个。
在有机物:①CH3CH3、 ②CH2=CH2、 ③CH3CH2C≡CH、
④CH3C≡CCH3、 ⑤C2H6、 ⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)