喹硫平可用于精神疾病的治疗,其结构为: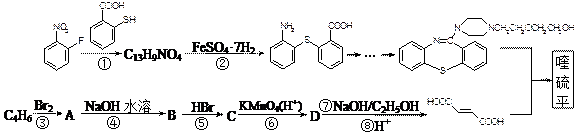
(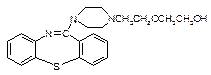 )2·
)2·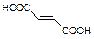 ,它的合成路线如下:
,它的合成路线如下:
已知:(Ⅰ)反应①为取代反应;(Ⅱ)A的系统命名为1,4-二溴―2―丁烯。
请回答下列问题:
⑴写出分子式为C13H9NO4S的物质的结构简式 。
⑵物质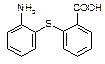 中除硫醚键(-S-)外,还含有的官能团名称为 。
中除硫醚键(-S-)外,还含有的官能团名称为 。
⑶反应③的类型是 反应,反应⑤的目的是 。
⑷写出反应④的化学方程式 。
⑸物质B的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有 种。
⑹已知:-SH的性质与-OH相似。
物质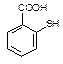 一定条件下形成聚合物的结构简式为 。
一定条件下形成聚合物的结构简式为 。
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)。
(4)如果没有装置C的设计,会导致。
(5)用离子方程式表示虚线框E中所增加装置和试剂的作用:。
(6)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,
请写出反应的离子方程式:。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③。
为探究溶液的组成,实验如下:
| 实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 |
说明:假设②不成立,假设①或③成立;的离子方程式是。 |
|
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 |
溶液紫红色退去 |
说明:。 |
综合上述实验分析,所得溶液中含有的金属阳离子有。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式。
(2)如图所示,过滤操作中的一处错误是。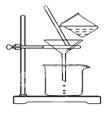
判断流程中沉淀是否洗净所用的试剂是。高温焙烧时,用于盛放固体的仪器名称是。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。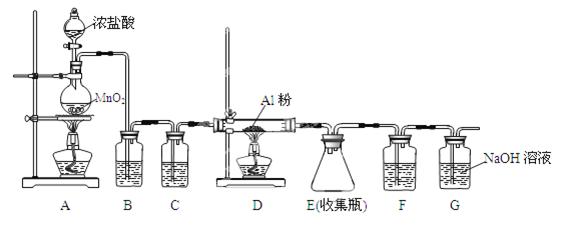
装置B中盛放饱和NaCl溶液,该装置的主要作用是;F中试剂的作用是;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为g。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 |
条件 |
现象 |
结论 |
|
| 温度/℃ |
催化剂 |
|||
| 1 |
40 |
FeCl3溶液 |
||
| 2 |
20 |
FeCl3溶液 |
||
| 3 |
20 |
MnO2 |
||
| 4 |
20 |
无 |
试回答:实验1、2研究的是其他条件相同时对H2O2分解速率的影响。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验。完成该实验应该测定的实验数据是____________________________________________。
实验室需用CuSO4·5H2O体配制480mL0.1mol/L的CuSO4溶液,请回答下列问题:
(1)应用托盘天平称取CuSO4·5H2O晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的CuSO4·5H2O晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)配制过程中有几个关键的步骤和操作如下图所示:将这些实验步骤A—F按实验过程先后次序排
列。
其中定容的具体操作是。
(5)以下情况会使所配溶液的浓度产生何种影响(A.偏高 B.偏低 C.不变,填序号。):
①溶解晶体用的烧杯和玻璃棒未洗涤:____________;
②定容时俯视刻度线:____________;
③所用CuSO4·5H2O晶体已失去部分结晶水:____________。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母)。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示:
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol)。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H=(取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数