某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示:
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H= (取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
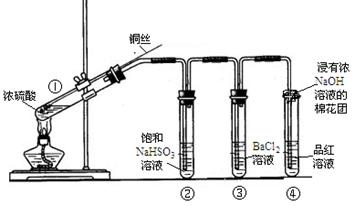
某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):
已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上。
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间。
(1)试管A中发生的主要反应的化学方程式为。
(2)试管B中出现白色沉淀的原因是。
(3)试管C中溶液褪色,说明SO2具有(填“漂白性”或“氧化性”或“还原性”),请将该反应的离子方程式补充完整:
(4)试管D中发生反应的离子方程式为。
(5)下列叙述正确的是。
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后, B中的液体不会倒吸,因为空气可经导管F进入试管A,使压强平衡
下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
|
| 加入试剂 |
现象 |
反应的离子方程式 |
|
| 第一份 |
加入NaOH溶液 |
有白色沉淀生成 |
____________ |
| 第二份 |
加入氯水 |
有白色沉淀生成 |
____________ |
完成上述反应的离子方程式。
(4)④中棉花团的作用是 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是 。
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
| 实验序号 |
实验步骤(内容) |
现象 |
| ① |
在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观。 |
|
| ② |
分别滴入几滴水,振荡,摸试管底部。 |
试管放热现象更明显(填“a”或“b”)。 |
| ③ |
继续向两试管中分别加入10.0 mL水,用力振荡,观察现象。 |
|
| ④ |
再分别向两试管中滴加2滴酚酞溶液,观察现象。 |
溶液均变红,颜色较深的试管是_________(填“a”或“b”)。 |
| ⑤ |
最后分别向两溶液中滴加足量盐酸。 |
红色褪去,均有无色气体产生。经计算生成气体的量a_____b(填“>”“<”或“=”)。 |
| ⑥ |
加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末) |
(1)请帮助该小组同学完成实验报告中的内容。
(2)已知:20℃时Na2CO3的溶解度为20.5 g。由实验(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5 g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是,化学方程式是。
(3)由实验⑥可以得出的结论是,用化学方程式说明得出结论的原因。
电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:
(2)I中加入过量Fe粉 ,然后过滤,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是HCl。.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl3•6H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是。
(2)试剂A是。
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是。
a.检验Cl2的存在 b检验Fe3+的存在 c.检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是(填字母)。
某化学兴趣小组的同学选定稀硫酸和氢氧化钡溶液做中和反应的实验。在烧杯中加入一定量的氢氧化钡溶液后滴入几滴酚酞试液,再向烧杯中加入一定量的稀硫酸。用玻璃棒充分搅拌后过滤,得白色沉淀和无色液体。
【提出问题】无色液体是什么物质?(不考虑指示剂)
【猜想】①小明:无色液体是水;
②小岩:无色液体是Ba(OH)2溶液;
③小丽认为无色液体可能是溶液。
【实验探究】
(1)如果你是小组成员之一,你认为小明猜想的理由是;写出反应的离子方程式。
(2)你认为小岩的猜想(“正确”或“不正确”)。理由是。
(3)填写小丽的猜想,并针对她的猜想,请你设计实验验证是否正确。
| 实验步骤 |
实验现象及结论 |
【拓展应用】
(4)中和反应在生产、生活中应用十分广泛,其中医疗上可以借助中和反应,来减轻胃酸过多病人的痛苦。根据你所学的知识判断下列物质适合用来中和胃酸的是。
A.氢氧化钡B.碳酸氢钠C.氢氧化钠 D.氢氧化铝