有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径B>C;
②D、E、G是非金属元素,它们都可以跟氢化合生成气态氢化物HD、HE和HG,在室温时,G的单质与氢气暗处混合就爆炸,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
(1)A的名称是 ,B位于周期表中第 周期 族,C的原子结构示意图是
(每空l分)。
(2)E的单质颜色是 。
(3)A元素与D元素形成化合物的电子式是 。
(4)G的单质与水反应的化学方程式是 。
(5)F的元素符号是 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 (每空l分)。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
。
阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到E和R两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备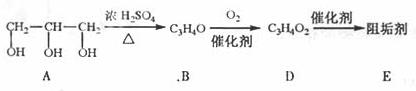
①A可由人类重要的营养物质________水解制得(填“糖类”、“油脂”或“蛋白质”).
②B与新制的Cu(OH)2反应生成D,其化学方程式为____________。
③D经加聚反应生成E,E的结构简式为____________。
(2)阻垢剂R的制备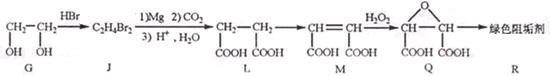
①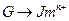
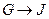 为取代反应,J的结构简式为____________。
为取代反应,J的结构简式为____________。
②J转化为L的过程中,L分子中增加的碳原子来源于____________。
③由L制备M的反应步骤依次为: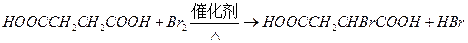 、____________、____________ (用化学方程式表示)
、____________、____________ (用化学方程式表示)
④1 molQ的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2molCO2,T的结构简式为____________(只写一 种)。
种)。
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=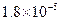 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=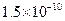
②25℃时,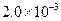 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: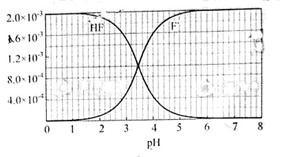
请根据以下信息回答下旬问题:图2
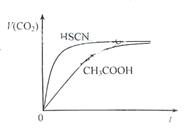
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka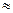 ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3)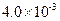 mol·L-1HF溶液与
mol·L-1HF溶液与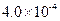 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
(16分)碘被称为“智力元素”,科学合理地补碘可防止点缺乏症。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如有图所示。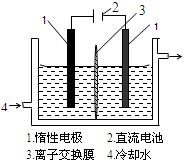
请回答下列问题:
(1)碘是___(填颜色)固体物质,实验室常用____方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2 + 6KOH =" 5KI" + KIO3 + 3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________________________;阴极上观察到的实验现象是______________________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 |
实验现象及结论 |
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下: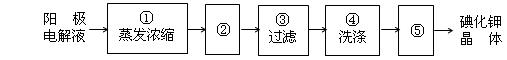
步骤②的操作名称______,步骤⑤的操作名称是____________
步骤④洗涤晶体的目的是_______________________________。
某天然碱的化学组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),下面是利用天然碱制备小苏打和烧碱的流程图。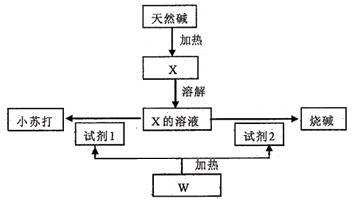
回答下列问题:
(1)向X的溶液中滴入酚酞试液后溶液显色,原因是(写离子方程式)
。向上述溶液中滴人过量的CaCl2溶液,观察到的现象是。
(2)上述由X制备小苏打和烧碱的化学方程式:。
(3)若取3 32g天然碱样品充分加热收集到0.112L(标况)CO2和0.45g H2O,将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,试推算该天然碱的化学组成。
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2=+6H2O
工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______理由:________
③条件:_______理由:________