(16分)碘被称为“智力元素”,科学合理地补碘可防止点缺乏症。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如有图所示。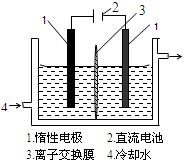
请回答下列问题:
(1)碘是___(填颜色)固体物质,实验室常用____方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2 + 6KOH =" 5KI" + KIO3 + 3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________________________;阴极上观察到的实验现象是______________________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 |
实验现象及结论 |
| |
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下: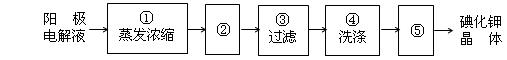
步骤②的操作名称______,步骤⑤的操作名称是____________
步骤④洗涤晶体的目的是_______________________________。
CuSO4溶液是中学化学及工农业生产中常见的一种试剂.
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是 .
(2)该同学利用制得的CuSO4溶液,进行以下实验探究.
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池.电解质溶液甲是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 .
②图二中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 .若把II中电极均换为惰性电极,电解时的化学反应方程式为 .若把II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH= (假设电解后溶液体积不变).
(3)将蓝矾(CuSO4•5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4•yCu(OH)2].为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体.所得数据显示n(HCl):n(CuO)=3:2,则该碱式硫酸铜的化学式中x:y= .
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察图,然后回答问题.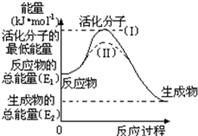
(1)已知热化学方程式:H2(g)+ O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 ;
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 ;
(2)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,你认为最可能的原因是 .
在一定温度下,把2摩SO2和1摩O2通入一个一定容积的密闭的容器里,发生如下反应:
当此反应进行到一定程度时,反应混和物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(摩).如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白:
(1)若a=0,b=0,则c= .
(2)若a=0.5,则b= 和c= .
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): .
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全满或半满.
(1)写出四种元素的元素符号:A ;B ;C ;D .
(2)写出C、D两种元素基态原子的电子排布图:C D
(3)写出B、C两种元素单质在一定条件下反应的化学方程式: .
(4)写出B元素单质和氢化物的电子式,单质 ,氢化物 .
依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题: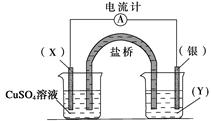
(1)电极X的材料是__________,电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为___________; X电极上发生的电极反应为_________________________。
(3)外电路中的电子是从__________电极流向________电极。