发生化学反应时,破坏化学键需要 能量,形成化学键需要 能量。吸收能量用E1表示,释放能量用E2表示,当E1 E2时,反应吸收能量;当E1 E2时,反应释放能量。
除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| 试剂 |
离子方程式 |
|
| ①NaHCO3溶液(Na2CO3) |
||
| ②Fe2O3(Al2O3) |
||
| ③FeCl3溶液(FeCl2) |
||
| ④CO2(HCl) |
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)B元素位于元素周期表中第周期,第族。
(2)由元素C与Mg元素形成的化合物的化学键的类型。
(3)由元素A与氢元素形成的化合物的结构式。
(4)由元素B与氢元素形成的化合物的电子式。
(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式:。
800℃时,在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),测得n(NO)随时间的变化如下表,请回答:
2NO2(g),测得n(NO)随时间的变化如下表,请回答:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c (NO)=;
(2)用O2表示从0~2s内该反应的平均反应速率为;
(3)下图中表示NO2变化的曲线是;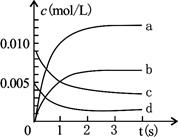
(4)能说明该反应已达到平衡状态的是。
a.容器内气体总物质的量保持不变
b.正反应和逆反应的速率都为0
c.容器内NO、O2、NO2物质的量之比为2∶1∶2
d.容器内NO气体的体积分数不变
下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是,最活泼的金属元素是,最活泼的非金属元素是。
(2)表中能形成两性氧化物的元素是 ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式。
(3)③⑥⑦三种元素原子半径由大到小的顺序是 。
(4)用电子式表示由元素⑨⑦形成化合物的过程:。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
原电池是直接把化学能转化为电能的装置。
(1)如图1所示:在Cu-Zn原电池中,Zn极发生反应(填“氧化”或“还原”),写出电极反应式。Cu极为极,发生的电极反应为。

(2)请根据化学反应:Cu+2FeCl3=CuCl2+2FeCl2设计原电池,在图2方框内画出装置图,并用离子方程式表示电极反应。
负极反应为。
正极反应为。