【化学——选修:有机化学基础】( 15分)
通常羟基与烯键碳原子相连接时,易发生如下转化: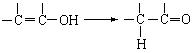
现有如图所示的转化关系: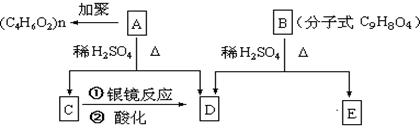

其中E能使FeCl3溶液显紫色,遇Na2CO3溶液产生CO2气体,且测出E的核磁共振氢谱有4个峰,其面积之比为1:2 : 2 :1。
请根据以上信息回答下列问题:
(1)A的结构简式为 ;
(2)由A生成C和D的化学方程式为 ;
(3)由E生成C7H5O3Na的化学反应方程式为 ;
(4)若由E反应生成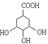 ,则中间共需经历 步反应才能实现(除最后一步酸化外);
,则中间共需经历 步反应才能实现(除最后一步酸化外);
(5)请写出同时符合下列要求的E的所有同分异构体的结构简式:
。
①含苯环 ②苯环上一氯代物有两种 ③能发生银镜反应,不能发生水解反应
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
| 化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
∞ |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:______________、______________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是________________、________________。
Ⅱ.乙酸正丁酯精产品的制备
(1)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤,正确的操作步骤是__________(填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
(2)将酯层采用如下图所示装置蒸馏。
①写出上图中仪器A的名称______________,冷却水从__________口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在__________左右。
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成水的体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率为__________。
如图示的转化关系,已知C为密度最小的气体,甲是电解质。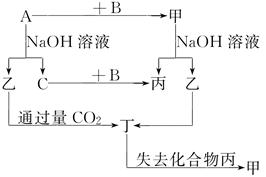
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________,B________,乙________,丁________。
(2)组成单质A的元素在周期表中的位置是________,丙的电子式是________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________。
②乙与过量CO2反应的离子方程式________________________________________________________________________
________________________________________________________________________。
如图在试管甲中先加入2 mL 95%的乙醇,并在振荡下缓慢加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸钠(CH3COONa)。将试管甲固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按图连接好装置进行实验,当试管乙中有明显现象时停止实验。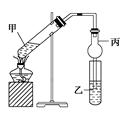
试回答:
(1)实验时,应对试管甲缓慢加热,其目的是________________________________________________________________________
________________________________________________________________________。
(2)写出试管甲中发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)加入浓硫酸的作用是____________、____________、____________。
(4)该实验中球形管丙的作用是____________________________________。
(5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因:____________________。
某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。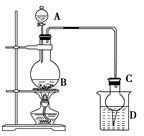
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:_____________________________________________________________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________________________________________;
反应结束后D中的现象是_______________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入________(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。已知X中铁、碳的元素质量比为14∶1。X的最简式为__________。
(2)X有下列转化关系:(无关物质已经略去)
溶液甲中含有的大量阳离子是________________;溶液甲中加入H2O2发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z__________、W__________。
(4)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们:________________________。
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下: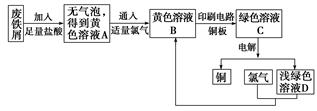
①写出废铁屑与盐酸反应的离子方程式:
________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 实验内容 |
实验操作 |
预期现象和结论 |
| 检验黄色溶液A中是否含有Fe2+ |
||
| 检验绿色溶液C中是否含有Fe3+ |