工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: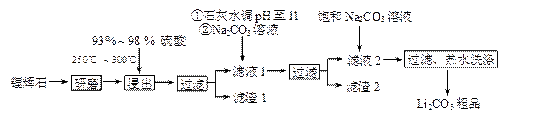
已知:① Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 ______。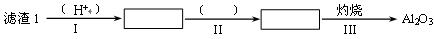
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3写出生成滤渣2反应的离子方程式:
 。
。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
(11分)某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验
(1)A中反应的化学方程式为:
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白: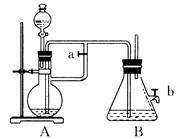
(1)B中盛有溶液,A中应预先加入的药品是________,A中反应的离子方程式是:_________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程________。这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生反应的化学方程式为:____________________。现象
甲、乙、丙三位同学,分别在相同条件下用乙酸与乙醇反应来制取乙酸乙酯,但未用饱和Na2CO3溶液来吸收。
(1)甲、乙、丙同学将得到的酯提纯,在未用指示剂的情况下,他们都先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来。但得到的结果却不同:①甲得到了不溶于水的中性酯;②乙得到显酸性的酯;③丙得到大量水溶性物质。试分析产生上述各种现象的原因。
(2)丁同学为了进一步找出原因,将所得产物进行了分离探究,他的实验操作步骤流程
如下图。请你帮他完成该实验并填写下列空白。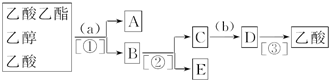
分离出的物质名称:A,B,C,D,E;
选择的试剂:a,b;
分离物质的方法:①,②,③。
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下: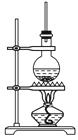
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精;加入酒精的作用为_______________________________。
(2)向所得混合物中加入____________________,静置一段时间,溶液分为上下两层,肥皂在__________层。
(3)图中长玻璃管的作用是________________________________________________。
(4)写出该反应的化学方程式______________________________________________。