(11分)某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证 卤族元素性质的递变规律。图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
(2)甲同学设计的实验中所涉及反应的离子方程式分别为___________________________________________________;
________________________________________________________________________。
(3)乙同学的实验原理是______________________________________________。
写出B处的离子方程式: ___________________________________________________。
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中;
C.容量瓶内壁沾有水滴没有烘干就进行配制;
D.定容时俯视;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
某同学应用如下所示装置研究物质的性质。其中气体C的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: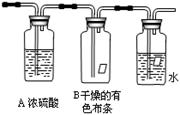
(1)该项研究的主要目的是探究氯气与水反应后生成的物质具有性。
(2)浓硫酸的作用是。
(3)观察到的实验现象是B中,C中。
(4)从物质性质方面来看,这样的实验设计还存在事故隐患,事故表现在。要克服该事故隐患,选择的操作是下图的,
并写出与解决隐患相关的离子方程式表示:。
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。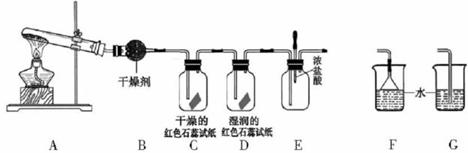
(1)A中的化学反应方程式:。
(2)A装置还可用于制取气体(只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物) B.NaOH 固体
C.硫酸溶液D.石灰石(含CaCO3))