短周期元素A、B、C、D在周期表中的位置如下图所示,回答下列问题:
| A |
B |
C |
| |
D |
|
(1)设A、B、C、D四种元素的原子序数之和为M,则M____________。
A.必为奇数 B.必为偶数 C.可能为奇数,也可能为偶数
 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
①D的元素符号为____________;
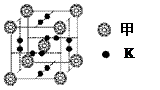
②B形成的一种单质分子(甲)可以和钾“掺杂”
在一起制造出化合物乙,其晶胞如右图所示,则该晶
体中甲分子和钾原子的个数比为 ;
(3)若D元素原子的次外层电子数等于其它各层电子数之和,则:
①用电子式表示D元素氢化物的形成过程 ;
②过量A元素的氢化物与D元素最高价氧化物对应水化物反应生成化合物Z,则 Z的水溶液中所有离子的浓度由大到小的顺序为 ;
Z的水溶液中所有离子的浓度由大到小的顺序为 ;
③用上述某元素的氢化物X与另一元素的氧化物Y反应,可生成一种强酸,则X、Y可能为:
和 ,或 和 (填分子式)。
选考(化学-物质结构与性质)
(1)基态铬原子的价电子排布式为。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:
K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
上述反应式中非金属元素电负性由大到小的顺序是(用元素符号表示)。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是。
(4)双氰胺结构简式如图所示。
①双氰胺分子中σ键和π键数目之比为。
②双氰胺分子碳原子的杂化类型为。
(5)镍元素能形成多种配合物,配离子[Ni(CN)4]2+中不含有的作用力是(填选项编号)。
| A.离子键 |
| B.配位键 |
C. 键 键 |
D. 键 键 |
E.氢键
(6)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图所示,则其化学式为。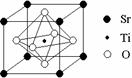
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用(填选项序号)。
A.酸性KMnO4溶液B.双氧水C.浓硝酸D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是(填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过、、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数。
Cu(OH)2+2H+反应平衡常数。
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题: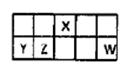
(1)写出X的原子结构示意图。
(2)列举一个事实说明W非金属性强于Z。
(3)含Y的某种盐常用作净水剂,其净水原理是(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10。处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)c(HCN)(填“>”、“<”或“=”)。
(5)已知:
①C(s)+O2(g)===CO2(g);△H ="a" kJ·mol-1;
②CO2(g) +C(s)===2CO(g);△H ="b" kJ·mol-1;
③Si(s)+ O2(g)===SiO2(s);△H ="c" kJ·mol-1。
工业上生产粗硅的热化学方程式为。
(6)已知:CO(g)+H2O(g)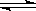 H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
该反应的△H0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为。
(7)一种新型氢氧燃料电池工作原理如下图所示。
写出电极A的电极反应式。
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。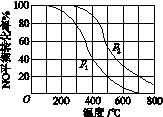
①比较p1、p2的大小关系:。
②随温度升高,该反应平衡常数变化的趋势是。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)。
②N2O4与O2、H2O化合的化学方程式是。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
为使电解产物全部转化为NH4NO3,需补充A。A是,说明理由:。
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为____________;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序______________________________。