能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+ 2H2(g) CH3OH(g);ΔH1
CH3OH(g);ΔH1
反应II:CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g);ΔH2
CH3OH(g)+ H2O(g);ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g); ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g); ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: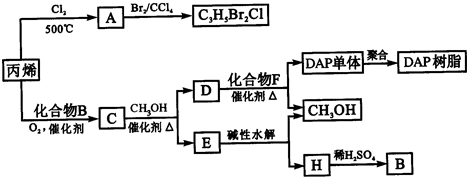
已知酯与醇可发生如下酯交换反应: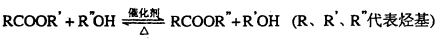
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
A的结构简式是__________________;A中所含官能团的名称是____________________。
丙烯→A的反应类型是_______________;A→C3H5Br2CI的反应类型是_____________。
(2)A水解可得到D.该水解反应的化学方程式为:
_______________________________________________________________________.
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,S中各元素的质量分数分别为:碳60%,氢8%,氧32%. S的结构简式为_________________________________.
(4)下列说法正确的是______________(填字母代号)。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是__________________。
(6)F的分子式为C10H10O4.。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。足量D和F反应生成DAP单体的化学方程式为:
_______________________________________________________________________.
(7)实验室由2-丙醇制备丙烯时,还产生少量SO2、 CO2及水蒸气,某同学用以下试剂
检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)。
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
钙是自然界存在最广泛的IIA族元素,常以化合物N存在。从钙单质起始发生的一系列化学反应可由下图表示:
(1)钙元素在周期表中位于第______周期;Y中存在的化学键类型为_______________;N的化学式是______________。
(2)M与水反应的化学方程式为______________________________________________.
(3)Z和G的电子式分别为_______________________和_________________________.
(4)Z与R反应可能生成的盐有________________________________(填化学式)。
(5)实际生产中,可由N为原料制备单质钙,简述一种制备方法:
_________________________________________________________________________.
(6)金属钙线是炼制优质钢材的脱氧脱磷剂。某钙线的主要成分含Fe元素和Ca元素。
请配平下列用钙线脱氧脱磷的化学方程式:
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为。
| 时间/min浓度(mol/L) |
NO |
N2 |
CO2 |
| 0 |
1.00 |
0 |
0 |
| 10 |
0.58 |
0.21 |
0.21 |
| 20 |
0.40 |
0·30 |
0.30 |
| 30 |
0.40 |
0.30 |
0.30 |
| 40 |
0.32 |
0.34 |
0.17 |
| 50 |
0.32 |
0.34 |
0.l7 |
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K=(保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是(填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率(填“增大”、“不变”或“减小”)。
I.对羟基肉桂酸是一种强效的导电材料,近年来在液晶显示器工业中应用广泛。结构简式如右图:
(1)该有机物的分子式为,其含氧官能团的名称是。
(2)该有机物能发生的反应类型是(填写代号)。
| A.氧化反应 | B.消去反应 | C.加聚反应 | D.水解反应 |
Ⅱ.塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂。增塑剂DEHP(C24H38O4)可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。
回答下列问题:
(1)E的结构简式是
(2)B→C的反应类型是
(3)3—甲基庚烷的某同分异构体核磁共振氢谱显示只有一种氢,写出该同分异构体的结构简式并命名:
①结构简式②命名
(4)DEHP的结构简式是
(5)F是E的一种同分异构体,具有如下特征: a.是苯的邻位二取代物; b.遇FeCl3溶液呈紫色;
c.能与碳酸氢钠溶液反应。写出F与NaHCO3溶液反应的化学方程式:
已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:.
(1)单质B的组成元素在周期表中的位置是 。
(2)戊的化学式为。戊与强碱反应的离子方程式:。
(3)NaClO的电子式为。
(4)甲与水反应的化学方程式为。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536 kJ热量,其热化学方程式为:。