周期表中有X、Y、Z三种元素,已知:①X原子核外电子排布占有3个轨道,并且其第一电离能在同周期中按由大到小的顺序排列居第三位。②Y位于X的相邻周期,且Y最外层的p轨道有一个未成对电子。③Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Z元素原子的价电子排布式为 ,其能与一些分子或离子形成配合物,[Z(CN)6]4-中离子CN-的电子式为 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 此液体具有的性质是 。
A.光束通过该液体时形成光亮的“通路”
B.插入电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀生成
D.将该液体加热、蒸干、灼热后,有氧化物生成
(3)①常温下,将20mL 0.1mol·L—1Y的最高价氧化物对应水化物的水溶液与VmL 0.1mol·L—1 X气态氢化物的水溶液混合后pH=7,则V 20mL(填“>”“<”或“=”)。
②常温下,将pH=2的Y的最高价氧化物对应水化物的水溶液V1mL与V2mL0.0lmol·L—1X气态氢化物的水溶液混合后,溶液呈酸性,则V1与V2的关系满足
A.V1>V2 B.V1<V2 C.V1=V2 D.无法确定
此时溶液中离子浓度大小顺序可能为
A.c(YO4—)>c(XH4+)>c(H+)>c(OH—)
B.c(YO4—)>c(H+)>c(XH4+)>c(OH—)
C.c(YO4—)>c(XH4+)=c(H+)>c(OH—)
D.c(H+)>c(YO4—)>c(XH4+) >c(OH—)
(4)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②
4NH3(g)+5O2(g) 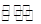 4NO(g)+6H2O(g);△H=-905kJ/mol①
4NO(g)+6H2O(g);△H=-905kJ/mol①
4NH3(g)+3O2(g)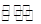 2N2(g)+6H2O(g);△H=-1268kJ/mol②
2N2(g)+6H2O(g);△H=-1268kJ/mol②
下列说法正确的是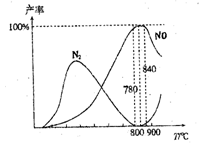
A.工业上进行氨催化氧化生成NO时,温度应控制在 7800C~8400C之间,且7800C时的平衡常数大于8400C时的平衡常数
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0之间,主要是为了提高反应速率
C.在加压条件下生产能力可提高5~6倍,主要是因为加压可提高原料的转化率
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g)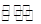 2NO(g); △H=-181.5kJ/mol
2NO(g); △H=-181.5kJ/mol
有机物A可以通过不同的反应得到B和C: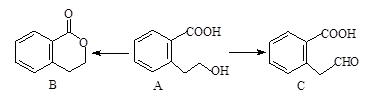
(1)A的分子式为,C的含氧官能团名称为。
(2)A制取B的有机反应类型为;A制取C的化学方程式为:。
(3)A发生消去反应后产物的结构简式为,A分子中一定共面的碳原子有个。
(4)芳香族化合物D是A的同分异构体,1molD可以和3mol NaOH发生中和反应;D苯环
上的一氯代物只有一种且分子中没有甲基。请写出D的结构简式(任写一种)。
有关FeSO4的转化关系如下图所示(无关物质已略去)。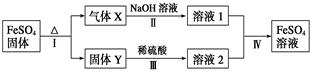
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
如图中,A、B、C、D、E是单质G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知: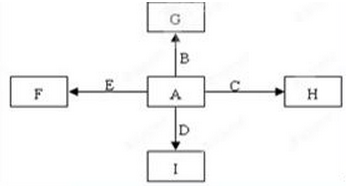
①若G为红棕色固体,反应C+G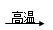 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为______________________________;
(2)3.2 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量为
(3)C与过量NaOH溶液反应的离子方程式为______________________,
(4)E在I中燃烧观察到的现象是___________________________________
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺的流程如下: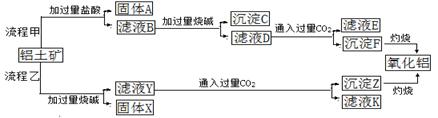
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为____________________________.
(2)流程乙加入烧碱后生成SiO32—的离子方程式为______________________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是____________(填化学式),写出该溶液的一种用途____________
(5)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10—12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________.
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是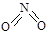 和
和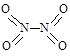 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是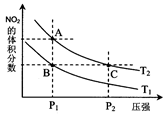
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.050 |
n2 |
0.080 |
0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3n4(填“>”、“<”或“=”),该反应的平衡常数K的值为,升高温度后,反应2NO2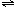 N2O4的平衡常数K将(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。