聚酯纤维是化学纤维中的第一大品种,聚已二酸乙二酯就是一种重要的聚酯纤维,可用于制造性能各异的聚氨酯泡沫塑料,弹性体、涂粘和粘接剂等。目前经典的合成路线是使用来源丰富的有机原料A和常见单质D,经过一系列反应,同时合成聚已二酸乙二酯与另一种生产生活中常用高聚物E,合成路线如下图所示。根据图示回答下列问题:
(1)写出E、G的结构简式:E ,G ;
(2)反应②的化学方程式(包括反应条件)是 。
反应④的反应条件是 ;
(3)写出①、⑤的反应类型:① ,⑤ 。
(4)满足下列构成条件的G的同分异构体有 种。
|
A.分子中有2个-COOH; B.分子中有1个—CH—,2个CH2—
(5)某同学查阅资料后提出,也可以用A与某种无机分子反应,直接得到F,该反应的原子利用率为100%,请写出该反应的化学方程式(不必注明反应条件)。
为测定某卤代烃的组成, 某同学设计实验如下:①量取该卤代烃液体11.4mL, 加入适量NaOH溶液, 加热反应至液体不分层;②冷却后用稀硝酸酸化, 再加入过量硝酸银;③过滤沉淀, 洗涤沉淀2~3次;④将沉淀干燥后称重。
回答下列问题:
(1)①中加入NaOH的目的是____________________________________________________
(2)②中加入过量硝酸银的目的是______________________________________________
(3)若②中生成的沉淀为淡黄色, 则该卤代烃中的卤原子是________
(4)若称得沉淀的质量为37.6g, 又测得卤代烃的密度为1.65g·mL-1, 其蒸气密度是相同条件下氢气密度的94倍。则该卤代烃分子中含有________个卤原子。
(5)写出该卤代烃可能的结构简式和名称:_________________
(12分)(1)乙烯、乙炔、甲苯、苯乙烯(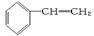 )4种有机物分别在一定条件下与H2充分反应。
)4种有机物分别在一定条件下与H2充分反应。
①若烃与H2反应的物质的量之比为1∶3,说明该烃分子是______________。
②若烃与H2反应的物质的量之比为1∶2,说明该烃分子是______________。
③苯乙烯与H2完全加成的物质的量之比为________。
(2)按分子结构决定性质的观点可推断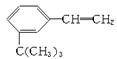 有如下性质:
有如下性质:
①苯基部分可发生________反应和________反应;
②—CH===CH2部分可发生________反应和________反应;
该有机物滴入溴水后生成产物的结构简式为_____________________;
(8分)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
乙烷(乙烯);苯(溴);
乙炔(H2S);溴苯(溴)。
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
①A的电子式是
②加热条件下A与B在溶液中反应的离子方程式
③C中含有的化学键类型为:
④铝可以与B的某溶液反应,写出此反应的离子方程式
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
最外层电子占核外电子总数的3/8[来 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,其中子数为8,则这种同位素的符号是。
(2) Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:
(3)T与X形成的常见化合物的结构式为:
(4)Z所在族元素的四种氢化物水溶液中,酸性最弱的物质的化学式为:
(5)T的同主族短周期元素M,M的氢化物与T的氢化物比较,沸点较高的是(填化学式),请解释原因: