工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4 Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
请回答相关问题:
(1)Fe2O3俗称为 不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为
(2)A瓶所盛试剂的作用是 C瓶所盛试剂的作用是
,用冷水冷却的原因是 ;B瓶所盛的试剂是
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是 (填编号)
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
理由是
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是 ,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为 mol.
(9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。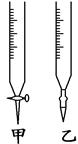
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
| A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。 |
| B.酸式滴定管滴定前有气泡,滴定后气泡消失。 |
| C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。 |
| D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。 |
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是______。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”理由是________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________。
如图为实验室分离水和乙醇的装置图,根据图示回答下列问题。
(1)图中的两处明显的错误是:______________________________,______________________________。
(2)A仪器的名称是____________,B仪器的名称是_______________。
(3)实验时向A中加入少量碎瓷片的作用是:________________________________。
(4)实验后锥形瓶中所收集到的主要物质为____________。
(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。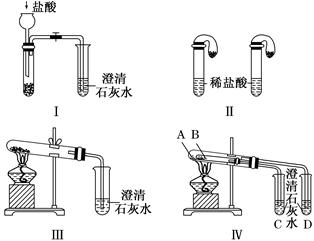
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:__________________;
与实验Ⅲ相比,实验Ⅳ的优点是__________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: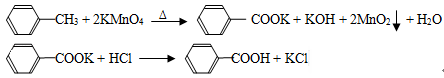
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为,操作Ⅱ为。
(2)无色液体A是,定性检验A的试剂是,现象是。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体B加入水中,加热溶 解, |
得到白色晶体和无色溶液 |
----------------- |
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl— |
| ③ |
干燥白色晶体, |
熔点为122.4℃ |
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为(保留二位有效数字)。