(16分)
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.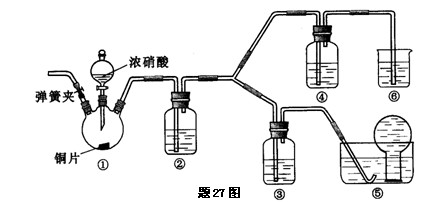
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O(1)装置①中发生反应的离子方程式是 .
(2)装置②的目的是 ,发生反应的化学方程式是 .
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
目的是 .
(5)该小组得出的结论所依据的实验现象是 .
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: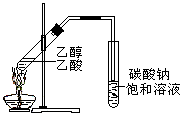
(1)写出制取乙酸乙酯的化学反应方程式,并指出其反应类型:_____ ,属于_______________反应。
(2)浓硫酸的作用是:①_________________________;②____________________。
(3)装置中通蒸气的导管要插在_____________溶液的液面上,不能插入溶液中,目的是防止_______ 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
A.蒸馏 B.分液 C.过滤 D.结晶
(5)用30克乙酸与46克乙醇反应,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是______________。
A.29.5克 B.44克 C.74.8克 D.88克
关于卤化银分解实验的设计
有关卤化银的感光性,可按以下方法来进行实验:
试剂和仪器: 0.1 mol·L-1的NaCl、NaBr、KI溶液,2%的AgNO3溶液。500 mL圆底烧瓶、大烧杯、聚光电筒。
实验步骤:
(1)将3只预先注有4/5容积蒸馏水的圆底烧瓶用大烧杯垫托安置于讲台上,使之处于较好的视觉高度,编号。
(2)依次往上述烧瓶中加入2至5 mL NaCl、NaBr和KI溶液,振荡摇匀。
(3)慢慢地往烧瓶中滴加AgNO3溶液,边滴边振荡,可三名同学同时操作,3种胶体同时制作,便于比较。注意观察胶体形成的效果,要求胶体颜色明显,无浑浊状态。
(4)胶体制备好后,记录时间,用聚光电筒进行爆光(或置于阳光下),观察分解反应的速度及颜色等现象的变化,做好记录。
结论:分解速率:在同样光照条件下,AgBr分解最快,先由浅黄色透明状变成灰黑色浑浊态,时间约2 min;AgCl次之,由乳白透明状变成灰白浑浊态;AgI最慢,较长时间才略有变化。
问题:
1.你认为本实验有何优点?
2.18世纪70年代.瑞典化学家舍勒在研究一种白色、难溶于水的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味的气体产生。此盐是
A.氟化银 A.氯化银 C.溴化银 D.碘化银
(15分,除标明外,每空2分)已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11-0℃。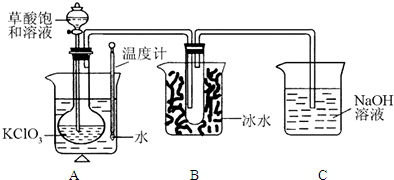
(1)该反应的反应原理如下,试配平该化学方程式KClO3+ H2C2O4=KHCO3+ClO2↑。
(2)B装置的作用是。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:。
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究。
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3: 。
②基于假设2,设计实验方案,进行实验。请在答题卷上写出实验步骤以及预期现象和结论。限选实验试剂:1 mo1·L-l H2SO4溶液、0.mo1·L-l盐酸、0.01 mo1·L-l KMnO4溶液、澄清石灰水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:____ |
___________________ |
| 步骤2:____ |
___________________ |
(10分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2===C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1 mL指示剂,立即用浓度为0.05000 mol·L-1的I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是_____________。
(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用。煮沸的目的是________________;冷却的目的是__________________。
(3)计算样品中维生素C的质量分数(要求列式,且式中各物理量带单位)。
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
| A.用碱式滴定管量取20.00mLNaOH溶液注入锥形瓶,同时滴加2-3滴酚酞试液; |
| B.用待测NaOH溶液润洗碱式滴定管; |
| C.把滴定管用蒸馏水洗净; |
| D.用标准HCl溶液润洗酸式滴定管后,将标准HCl溶液注入酸式滴定管至距离刻度“0”以上2—3cm处,再把酸式滴定管固定好,调节液面; |
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在酸式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入l滴酸液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)滴定操作的正确顺序是:(填字母)→C→→B→→→ __。
(2)G步操作中应在锥形瓶下边垫一张白纸的作用是。
(3)D步操作中液面应调节到。
(4)当观察到锥形瓶中,时,即可读数。若滴定前平视读数,滴定终点仰视读数,则由此计算得到的NaOH溶液浓度。(填“偏大”、“偏小”、“无影响”)