侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证 和
和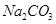 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞 、
、 的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
实验来源于生活且服务于生活,请回答些列问题: (1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )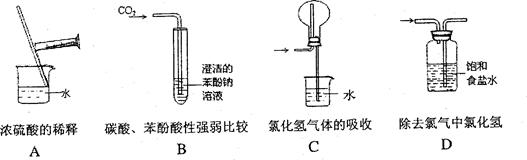
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。
挤压滴管的胶头,下列与实验事实不相符的是()
A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图) 。
。
若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( )
A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是()
| 物质 |
试剂 |
分离方法 |
|
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
重结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙醇(水) |
生石灰 |
蒸馏 |
| ④ |
苯(苯酚) |
浓溴水 |
分液 |
A.①② B.①③ C.只有③ D.③④
(10分)我国化学家侯德榜(下图所示)改革国外的纯碱生产工艺,生产流程可简要表示如下: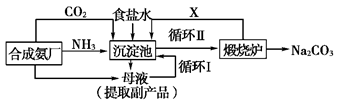
(1)请写出碳酸钠的一种用途 。
(2)写出上述流程中X物质的分子式 。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是 。
(4)该流程中氨气和二氧化碳的添加顺序是:先通氨气后通二氧化碳,请说明理由:。
(12分)某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH- 5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置,进行实验。
5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置,进行实验。
请回答下列问题:
(1)①甲装置用于制备氯气,其反应的化学方程式是;乙装置的作用是______。
②该兴趣小组用100mL 12mol/L盐酸与 8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可 制得Ca(ClO)2______________g。
制得Ca(ClO)2______________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢。匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。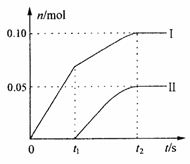
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:______。
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,根据碘水用量可计算SO2的量,与气体流量计数据之比即可判断SO2是否超标。
(1)已知二氧化硫与碘水的反应为:SO2+ I2+H2O==H2SO4+HI,配平该反应并指出还原剂。
I2+H2O==H2SO4+HI,配平该反应并指出还原剂。
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:尾气被过氧化氢氧化后与氢氧化钡反应,实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式。
(5)写出步骤②中反应的化学方程式 。
。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为(用含有V、m的代数式表示)。
(7)若将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同,你认为这样处理是否合理,说明理由:。
化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是(填反应序号)。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个 原电池。
原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极:;负极:。