火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出QKJ的热量。
(1)反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(3)在西部大开发的十大工和中, ”西气东输”是其中之一.
”西气东输”中的”气”是指( )
| A.水煤气 | B.裂解气 | C.天然气 | D.电石气 |
(4)2001年2月24日,中央电视台报道:近年来北京的空气质量提高,已石家庄Ⅱ级标准.这主要得力于搬迁一此气超标排放的工厂和大量使用燃气燃料,减少了SO2和粉尘的排放,特别是使用了许多的环保型汽车,排放污染值大大降低.已知1g甲烷完全燃烧生成气态水时放出热量50.125KJ.试写出甲烷燃烧的热化学方程式
某化学课外小组用铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式 。
(2)现用1 kg这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1∶0.56∶100混合配制成无机铜杀菌剂波尔多液:
①此波尔多液中Cu2+离子和Ca2+离子的物质的量比为________(最简整数比)。
②波尔多液有效成分的化学式可表示为CuSO4·xCu(OH)2·yCa(OH)2,此种配比当x=1时,试确定y的数值________。
Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
①写出磁铁矿主要成分的化学式:。
②写出赤铁矿还原成铁的化学方程式:。
③写出焦炭在高炉中所参与反应的两个化学方程式:。
④写出CaCO3所参与反应的两个化学方程式:。
青藏地区烧水的水壶,内壁往往结有一厚层水垢。经分析,其主要的成分是CaCO3、MgCO3和Mg(OH)2。
由此推测该地区天然水中可能含有的物质是。
已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验: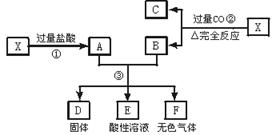
(1)写出①、②和③步所有反应的方程式:
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比。
下图中A~J是与生命、环境、能源等问题有关的几种物质。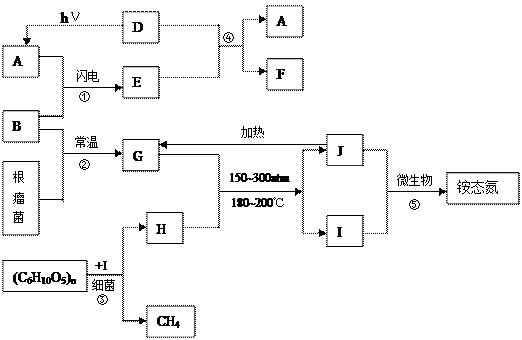
试根据上述转化关系回答:
(1)反应①②共同具有的化学生物意义是什么?
(2)在④的变化中,物质E所起的作用是;
(3)与H有关的环境公害是什么?列举导致这种公害的四大环境问题; (4) ⑤的离子方程式是,该反应的意义是什么?
(4) ⑤的离子方程式是,该反应的意义是什么?
(5)已知化学反应③可表示为(C6H10O5)n+IH↑+CH4↑+Q,请设想出这一总反应的实际价值和意义;
(6)1997年美国三位科学家因发现物质E具有多种生理学功能而荣获诺贝尔生理学和医学奖,请问:物质E是,简述其生理作用:;治疗心绞痛药物——硝化甘油之所以具有扩张血管的生理作用,是由于硝化甘油在人体体液中酶的作用下缓缓氧化自发释放出D分子,同时生成CO2、H2O,写出该反应的化学方程式。