银锌电池是广泛用做各种电子仪器的电源,其放电过程可表示为Ag2O+Zn==ZnO+2Ag,此电池放电时,负极上发生反应的物质是( )
| A.Ag | B.ZnO | C.Ag2O | D.Zn |
一定温度下,向某容积为VL的密闭容器中充入amol A和bmol B,发生反应:aA(g)+bB(s) cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )
cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )
A.5 min时,v(C)=x/5Vmol·L-1·s-1
B.缩小容器体积平衡一定发生移动
C.0~5 min 内,v(A):v(C)=a:c
D.0~5min内,用A表示的反应速率为xc/(300aV)mol·L-1·s-1
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是 ( )
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是 ( )
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
下列说法不正确的是 ( )
①0.1 mol·L-1盐酸和0.1 mol·L-1醋酸分别与0.2 mol·L-1氢氧化钠溶液反应的速率相同
②0.1 mol·L-1盐酸和0.1 mol·L-1硝酸分别与大小相同的大理石反应的速率不同
③大理石块与大理石粉末分别与0.1 mol·L-1盐酸反应的速率不同
④已知t℃时反应N2(g)+3H2(g) 2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
⑤合成氨中及时分离出氨气后可减小反应速率
⑥在合成氨反应中,相同条件下在有催化剂时(a)和无催化剂时(b)速率时间图像可用下图一表示
⑦在合成氨反应中,不同温度下(T2>T1)的NH3的体积分数与时间的关系图像可用图二表示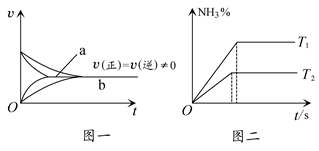
| A.除①⑦外 | B.除③⑤⑥外 | C.除③⑤外 | D.除③⑥⑦外 |
为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
| 实验 试剂/mL |
甲 |
乙 |
丙 |
丁 |
| 4 mol/L H2SO4 |
20 |
V1 |
V2 |
V3 |
| 饱和CuSO4溶液 |
0 |
2.5 |
V4 |
10 |
| H2O |
V5 |
V6 |
8 |
0 |
下列说法正确的是 ( )
A.实验甲产生气泡的速率最快 B.V1<V2<V3<20
C.V4=V5=10 D.V6=7.5
反应①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0;
FeO(s)+CO(g) ΔH>0;
反应②:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH<0。
FeO(s)+H2(g) ΔH<0。
若反应①在温度T1下进行,反应②在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),下面对两者反应速率大小判断正确的是( )
| A.反应①快 | B.反应②快 |
| C.一样快 | D.无法判断 |