某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答: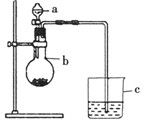
(1)仪器a的名称是 ,应盛放下列药品中的 。
A.稀硫酸 B.亚硫酸
C.氢硫酸 D.盐酸
(2)仪器b的名称是 ,应盛放下列药品中的 。
A.碳酸钙 B.硫酸钠
C.氯化钠 D.碳酸钠
(3)如果观察到C中的现象为 ,即可证明硫与碳的非金属性的强弱。
用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为mL,将浓硫酸缓缓倒入盛水的烧杯中后__ __(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有: A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
验时应选用的仪器有(填入编号)。
(3)定容时,若俯视液面,则所配溶液浓度 ____(填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制
目前市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装日期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a将碘的四氯化碳溶液置于分液漏斗中;
b加入适量;
c分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a准确称取wg食盐,加适量蒸馏水使其完全溶解;
b用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol·L-1的Na2S2O3溶液24.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
(1)A中发生的反应方程式:。
(2)试管C口部的棉团上发生反应的离子方程式是。
(3)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入Cl2气体,现象
(5)如果反应过程中要立即停止反应,最简单的方法是。
下图为实验室制取、检验和收集纯净干燥的氯气的实验装置图: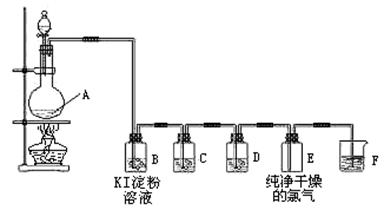
(1)装置A的化学方程式为:4HCl(浓)+MnO2 MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是;
MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是;
(2)装置B中的现象是,反应的化学方程式为。
(3)装置C中所装试剂是饱和食盐水,作用是除去;装置D中所装试剂是,作用是。
(4)装置F是氯气的尾气处理装置,发生反应的离子方程式。
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
50.00 |
342 |
| 硫酸钾 |
0.50 |
174 |
| 阿司匹林 |
0.35 |
180 |
| 高锰酸钾 |
0.50 |
158 |
| 硝酸银 |
0.04 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于强电解质的是________。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为________________ mol/L。(只要求写表达式,不需要计算)
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A、定容时俯视容量瓶刻度线
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理