目前市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装日期 |
|
| 分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a 将碘的四氯化碳溶液置于分液漏斗中;
b 加入适量;
c 分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c 以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol·L-1的Na2S2O3溶液24.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
(9分)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
(1)配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的 (填字母代号)。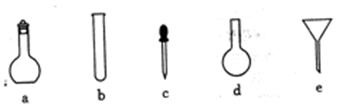
(2)滴定终点的现象是
(3)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样 w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为
(4)若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,则对TiO2质量分数测定结果的影响是 (填“偏高”、“偏低”或“无影响”)。
(14分)下图是实验室中制备气体或验证气体性质的装置图
(1)写出用发生装置A中制取氯气的化学方程式___________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:C12>Fe3+
则装置B中的溶液的作用是_______________________;
装置D中加的最佳试剂是(填序号)_________________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的___________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为__________________;
实验2有一处不严谨,应如何改进__________________。
资源综合利用既符合绿色化学理念,也是经济可持续发展的有效途径。一种难溶的废弃矿渣杂卤石,其主要成分可表示为: ,已知它在水溶液中存在如下平衡:
,已知它在水溶液中存在如下平衡:
为了充分利用钾资源,一种溶浸杂卤石制备K2S04工艺流程如下:
(1)操作①名称是
(2)用化学平衡移动原理解释:Ca(OH)2溶液能溶解出杂卤石中K十的原因:
(3)除杂质环节,为了除去Ca2+,可先加人 溶液,经搅拌等操作后,过滤,再向滤液中滴加稀H2 S04,调节溶液pH至 ;(填“酸性”、“中性”或“碱性”)
(4)操作②的步骤包括(填操作过程):、 、过滤、洗涤、干燥;
(5)有人用可溶性碳酸盐为溶浸剂,其浸溶原理可表示为:
则常温下该反应的平衡常数K=
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设①该反应的气体产物是CO2;②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案,如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。
(6)实验优化学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: 。
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下: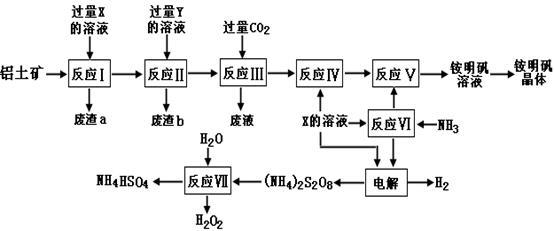
(1)废渣a、b 的成分分别是_______________、_______________。(写化学式)
(2)流程图中X的化学式为_______________。
(3)反应Ⅲ的离子方程式为________________,从铵明矾溶液中获得铵明矾晶体的操作依次为__________(填操作名称)、冷却结晶、过滤洗涤。
(4)反应Ⅶ的化学方程式为___________________。
(5)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的离子反应是 _______。(填选项字母)
| A.NH4+ + SO42— + Ba2+ + OH—= BaSO4↓ + NH3·H2O |
| B.2Al3+ + 3SO42— + 3Ba2+ + 6OH—= 3BaSO4↓ + 2Al(OH)3↓ |
| C.Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + AlO2— + 2H2O |
| D.NH4+ + Al3+ + 2SO42— + 2Ba2+ + 4OH—= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O |