(15分)有机化合物A~H的转换关系如下所示:
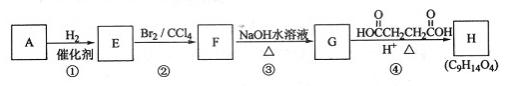
请回答下列问题:
(1)链烃A有南链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是 ;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是 ;③的反应类型是 ;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊为烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。
合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。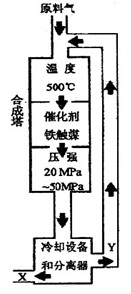
30. X的化学式为;X的状态为_______态。
31. 据右图分析,下列说法正确的是(填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为。
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是。阴极产物之一为H2,阴极上发生的变化为反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是(填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cud.3Cl2 + 2Fe
Cl2↑+ Cud.3Cl2 + 2Fe 2FeCl3
2FeCl3
下表是元素周期表的一部分,针对所给的元素,完成下列各小题。
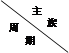 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
C |
N |
O |
||||
| 3 |
Na |
Al |
Si |
S |
Cl |
21. 第3周期中金属性最强的元素是(填元素名称)。
22. C、N和O原子半径由小到大的顺序的是。
23. 第3周期中气态氢化物最稳定的是(填化学式)。
24. Si是带来人类文明的重要元素之一,其氧化物化学式是。
25. 铝是大自然赐予人类的宝物。它的一个用途是发生铝热反应,冶炼某些难熔金属,写出
该反应的一个化学方程式。
26. S元素形成的氢化物与其氧化物SO2相遇后的现象是。
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行族。
在研究化学反应中的能量变化时,我们通常做下面的实验: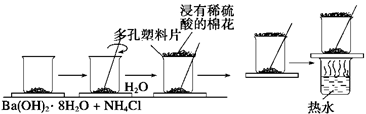
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 |
实验现象及结论 |
| 将晶体混合,立即快速搅拌 |
有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 |
感觉烧杯变凉说明此反应是_ ②反应 |
| 用手拿起烧杯 |
烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 |
玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 |
混合物成糊状,证明有_③___生成 |
(1)写出题目中①②③填入的内容
①②③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?
___________________________________________________________。