合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。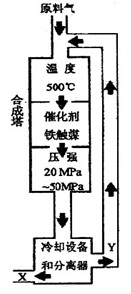
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
氧硫化碳(C0S)可替代磷化氢而被用作熏蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是 (填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是 (填字母)。
A.最高正化合价:P>C
B.同温同浓度的两溶液的酸性H3P04>H2 C03
C.沸点:PH3CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去)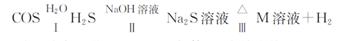
①已知:常温下,反应中每吸收1.7gH2S气体,反应放出热量4.76 kj,则该反应的热化学方程式为 。
②已知M溶液中硫元素的主要存在形式为S2032-,则反应中生成S2032-的离子方程式为 。
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价,如图所示。
(1)元素Z位于元素周期表的第 周期 族,X与Z可形成18电子的化合物,该化合物的电子式为 。
(2)非金属性: Y (填“ >”或“<”)D。
(3)单质F与EDX溶液反应的化学方程式为 。
(4)G和H可形成一种化合物,其相对分子质量在90〜110之间,且G的质量分数约为31.1%,该化合物的化学式为 。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+→ VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
写出符合下列条件的化学方程式(各举一例)
(1)一种非金属单质还原一种非金属氧化物____________________________
(2)一种非金属氧化物还原另一种金属氧化物___________________________
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:
固体混合物中肯定有 ,肯定没有 ,可能有 ,对可能有的物质,可采用滤液中滴加 溶液方法来检验。