(共4分)
(1)25℃时,水的离子积常数KW为1.0×10—14;在pH=2的稀硫酸中,c(OH—) = ;若升高温度,会使KW 数值 (填“增大”、“减小”或“不变”)。
(2)在醋酸水溶液中存在平衡CH3COOH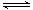 CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:__________________________________________________________;
实验②:__________________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 |
| C.Br2>Fe3+ | D.I->Br- |
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。(提示:请写出实验步骤、现象及结论)
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
__________________________________________________________________
__________________________________________________________________
氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、SO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验。
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收,也可使溴水褪色。
试回答下列问题:
(1)D的化学式是________,判断理由是___________________________________________。
(2)写出其余几种物质的化学式:A________,B________,C________。
(3)写出实验②中有关反应的离子方程式_______________________________。
(4)写出③中生成的气体与溴水反应的离子方程式_______________________。
标准状况下336 L的NH3溶于1 L水中,所得溶液的质量分数为________,若该溶液的密度为a g/cm3,则物质的量浓度为________。将上述氨水全部转化为NH4Cl,所需4 mol·L-1的盐酸的体积为________。
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。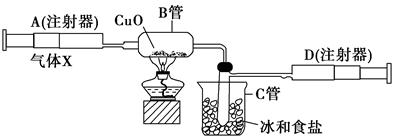
在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。