已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为:
AgCl(s)  Ag+(aq) + Cl-(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10 mol2·L-2
Ag+(aq) + Cl-(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10 mol2·L-2
现把氯化银(足量)分别放人:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答) 。在0.1mol·L-l氯化铝溶液中,银离子的物质的量浓度最大可达到 mol·L-1。
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式。
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4) 比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)。
比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)。
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是(填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
常温下,甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
(1)甲硅烷含有的化学键是_________ ,其在固态时属于晶体。
(2)试比较甲硅烷与氨气的稳定性由大到小排列(化学式表示)
(3)现有①BaCl2、②金刚石、③NH4Cl、④Na2O2、⑤干冰、⑥甲硅烷(SiH4)六种物质,
含有共价键的化合物是(填序号)
(4)已知室温下1 g甲硅烷自燃生成SiO2和水并放出热量44.6 kJ,则其热化学方程式为。
X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42—、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放250 mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极。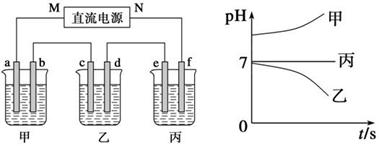
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)。
(2)甲烧杯中电极b上发生的电极反应为。
(3)乙烧杯电解的总反应离子方程式为_________________________________,电解一段时间后停止电解(此时溶液中还有原溶质),若要将乙烧杯中的溶液恢复到原状态,则需要加入(填化学式)。
(4)若经过一段时间后,丙装置中两极附近均滴酚酞, _______极附近变红,其原因是
。
(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: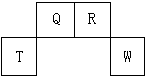
(1)W在周期表中的位置是_________________, Q、R、T三种元素原子的半径从大到小排列顺序__________ (用元素符号表示),Q的最高价氧化物的电子式_____________,R气态氢化物分子的结构式为_____________。
(2)元素的原子得电子能力:Q______W(填“强于”或“弱于”)。
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点(填“高”或“低”)于R的的常见气态氢化物。
(4)T、Q、R、W的单质中,固态时属于原子晶体的是_____________(填名称)。
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在上表中的对应编号__________,与T同周期且最高价氧化物的水化物碱性最强的元素在上表中的对应编号____________,编号为⑥的最高价氧化物的水化物的电子式。