
上图中均为有机化合物,根据图中的信息,回答下列问题:
(1)环状化合物的相对分子质量为82,其中含碳87.80%,含氢12.20%。的一氯代物仅有一种,的结构简式为;
(2)是的一种同分异构体,能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则的结构简式为;
(3)由生成的反应类型是,由生成的反应类型是;
(4)的分子式为,0.146g需用溶液完全中和,是一种高分子化合物。则由转化为的化学方程式为;
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应
则由和反应生成F的化学方程式为;
(6)中含有的官能团是,中含有的官能团是。
.(12分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产
生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性;常温下,0.1 mol/L
B溶液的pH大于13,0.1 mol/L C溶液的pH等于1
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有
气体产生;(沉淀包括难溶物和微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出A、B、C、D、E的化学式:A、B、
C、D、E
(2)写出A、E溶液反应的离子方程式:
。
(3)写出B溶液与C溶液恰好完全反应的离子方程式:
_____。
(4)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由小到大的顺序为(带两个单位电荷的离子不参与比较):__________________________________。
(12分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素的原子结构示意图为__________,该元素的符号是__________;
(2)Y元素原子的的价电子排布式为_______________________________,该元素的名称是__________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性
由高到低_____________________________________。
Ⅰ.下面是s能级p能级的原子轨道图,试回答问题: s电子的原子轨道呈形,每个s能级有个原子轨道;p电子的原子轨道呈形,每个p能级有个原子轨道。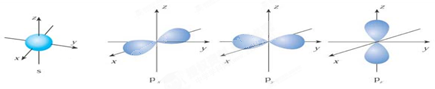
Ⅱ.写出下列元素基态原子的电子排布式:
(1)Ca。
(2)Kr。
(3)Co。
(4)Ge。
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X是结构有待探究的一种新型分子,其组成元素的相对原子质量相差18,下列框图中部分反应条件已略去。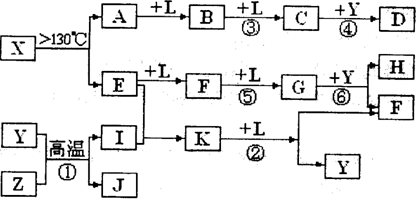
试回答下列问题:
(1)E的结构式为___________,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是___________。(填序号)
(2)写出反应②的化学方程式:_________________________________________
(3)若有G、F的混合气体通入足量烧碱溶液,气体全部被吸收,则气体G、F的物质的量之比应满足n(G)︰n(F)____________________
(4)J与过量H的稀溶液反应的离子方程式为___________________________________。
(5)t℃时,将2mol E和1mol I通入体积为2L的恒温密闭容器中发生反应,2min后达到平衡n(K)=0.2mol, 此时保持温度不变,体积减半,则E的体积分数如何变化____________(填“增大”、“不变”、“变小”)
已知2X2(g)+Y2(g) 2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
(1)此反应平衡常数表达式为____________________;若将温度降低到300℃,则反应平衡常数将______________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度___________Wmol·L-1(填“>”、“<”或“=”),a,b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是_____________________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变
c.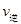 (X2)=2
(X2)=2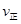 (Y2) d.容器内的密度保持不变
(Y2) d.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和lmol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”)。