(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
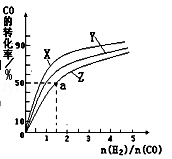
A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
| |
0min |
5min |
10min |
| CO |
0.1 |
|
0.05 |
| H2 |
0.2 |
|
0.2 |
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是。
写出“乙 丙”转化的离子方程式:。
丙”转化的离子方程式:。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:。
写出“甲 乙”转化的离子方程式:。.
乙”转化的离子方程式:。.
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中周期族
请写出C的电子式。
(2)A在B中燃烧的现象是。
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=。
(4)G+J→M的离子方程式是。
写出C+F→G的离子方程式是。
(5) 受热分解的化学方程式是。
受热分解的化学方程式是。
有关元素X、Y、Z、W的信息如下:
| 元素 |
有关信息 |
| X |
原子半径为0.074 nm,其氢化物的结构模型可表示为: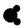 常温下是液体 常温下是液体 |
| Y |
原子半径为0.102 nm,其原子核外电子排布为: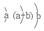 |
| Z |
人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W |
所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)Z在元素周期表中的位置是。
(2)Y与W相比,非金属性较强的是(填元素符号),下列事实能证明这一结论的是(填字母)。
a. W元素氢化物的稳定性大于Y元素氢化物的稳定性
b. W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c. W元素的单质能与Y元素的氢化物反应,置换出Y单质
d. W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子ZX42-,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
ZX42-具有强氧化性,能杀菌消毒,还原产物是Z3+,含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)。
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移mol电子,该反应中硫酸表现出的化学性质是。
(2)上述资料中的反应(填序号)可表示步骤ⅱ中的反应,通过该反应(填“能”或“不能”)说明碘的非金属性强于溴,原因是。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。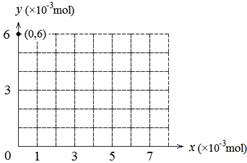
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为。
②反应B+A→C的离子方程式为。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为(填化学式),此时图b中x7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。