正极材料为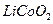 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型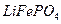 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过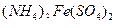 、
、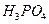 与
与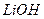 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将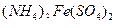 和
和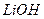 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向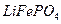 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的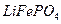 的导电性能外,还能 。
的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有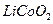 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。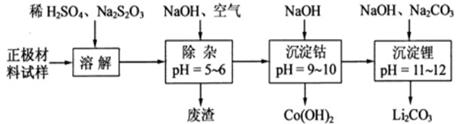
① 在上述溶解过程中,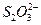 被氧化成
被氧化成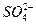 ,
,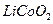 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。
② 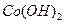 在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。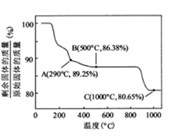
(12分) 向某密闭容器中加入0.3mol A、0.08mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示[t0~t1阶段的c(B)变化未画出]。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t4~t5阶段为增大容器体积(即减压)。
(1)写出该反应的化学方程式:。
(2)若t1 = 30s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) = ;t1~t2的平衡常数K =。
(3)若t2~t3阶段,C的体积分数在不断地变小,则此阶段没有平衡前v(正)v(逆)(填“>”、“=”或“<”)。
(4)t5~t6阶段改变的条件为; B的起始物质的量浓度为mol/L。
滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是。
②上述滴定过程中操作滴定管的图示,正确的是。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH溶液浓度(填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是(填字母序号)。
②判断滴定终点的依据是。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)沉淀滴定滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是(填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| KSP |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A、NaCl B、NaBrC、NaCND、Na2CrO4
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是。
(2)利用配制的CuSO4溶液及如图所示装置,进行以下实验探究。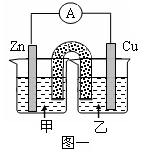
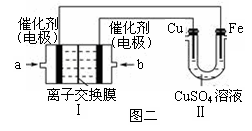
①图一是根据反应Zn+CuSO4Cu+ZnSO4设计成的锌铜原电池。甲池中的电解质溶液为(填化学式)______________,Cu极的电极反应式是__________________,盐桥中是含有琼胶的KCl饱和溶液,电 池工作时Cl-向________(填“甲”或“乙”)池移动。
②图二中,Ⅰ是氢气燃料电池(电解质溶液为KOH溶液)的结构示意图,电池总反应为:2H2+O2=2H2O。该同学想在Ⅱ中实现铁上镀铜,则a处加入的是________(填“H2”或“O2”),b处电极上发生的电极反应式是_____________________。
③若把图二Ⅱ中电极均换为惰性电极且CuSO4溶液足量,电解时的化学反应方程式为,
一段时间后,反应停止。下列物质能使Ⅱ池恢复到反应前浓度的是________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu(OH)2 |
(12分)(1)物质的量浓度相同的下列物质的溶液①NH4Cl②NH4HSO4③CH3COONH4,c(NH4+)由小到大的顺序是(填序号)。
(2)同浓度的下列溶液:①CH3COONH4②NH4Cl③Na2CO3④NaHCO3,其中pH由大到小的顺序 是。
(3)物质的量浓度相同的 ①盐酸、②硫酸溶液、 ③醋酸(CH3COOH)溶液各100 mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是。
(4)CH3COONa溶液呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)。
(5)常温时,若10体积pH1=a的盐酸溶液与1体积pH2=b的氢氧化钠溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2之间应满足的关系是_________________。
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。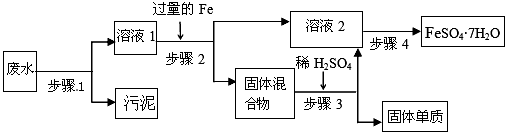
(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯外有________,________。
(2)步骤2中发生反应的离子方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。