有X、Y、Z、W、M五种短周期元素,其中X、 Y、Z、W同周期, Z、M同主族; X+ 与M2-具有相同的电子层结构;离子半径:Z2-
>W-;Y的单质晶体熔点高、硬度大,是一 种重要的半导体材料。下列说法正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定 |
| C.Z、W两元素的最高价氧化物对应水化物的酸性:Z > W |
| D.W、M两元素的某些单质或化合物可作为自来水消毒剂 |
某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物(可产生HBr)的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。
A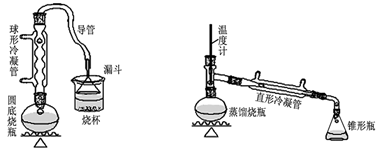 B
B
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗吸收,这样做的目的是。
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。该同学设计的鉴定方案(填“合理” 或“不合理”), 理由是:。
(4)为 了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至收集所得馏分。
(6分)一定条件下,在l L密闭容器 中C12(g)、S(g)发生反应(产物只有一种),三种物质的物质的量随时间变化的曲线如图所示,请回答下列问题:
中C12(g)、S(g)发生反应(产物只有一种),三种物质的物质的量随时间变化的曲线如图所示,请回答下列问题:
(1)生成物的化学式为。
(2)反应进行2 min时达到平衡,此时Cl2的平均反应速率v(Cl2)=。
(3)反应达到平衡时,S(g)的转化率为。
(8分)2009年“ 六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①
②
请回答下列问题:
(1)反应①的熵变 S(填“>”或“<”)0。
S(填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行?(填“可行”或“不可行”)。
(3)反应②中的 是不是CO的燃烧热?(填“是”或“
是不是CO的燃烧热?(填“是”或“ 不是”)。
不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为kJ(依 据反应①、②计算)。
据反应①、②计算)。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
C1 |
0.2 |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸。
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?(填“是”或“否”)。混合溶液中c(A-)与 c(Na+)离子浓度的大小关系是(填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
c(Na+)离子浓度的大小关系是(填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=mol·L-1。
在密闭容器中加入2molA和1molB发生反应2A(g)+B(g)  3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,以下配比作为起始物质: ① 4mol A+2mol B ② 2mol A+1mol B+3mol C+1mol D
3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,以下配比作为起始物质: ① 4mol A+2mol B ② 2mol A+1mol B+3mol C+1mol D
③ 3mol C+1mol D ④ 1mol A+0.5mol B+1.5mol C+0.5mol D
⑤ 3mol A+1mol B
(1)达平衡后,C的体积分数仍为ω的是________________。
(2)达平衡后,C的体积分数小于ω的是________________。
(3)若发生的反应为2A(s)+B(g)  3C(g)+D(g),即A的状态,由气态改为固态,
3C(g)+D(g),即A的状态,由气态改为固态,
其他条件不变,则C的体积分数为ω的是__ ______________。
______________。
(4) 若将题 中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是___________。
中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是___________。