下列实验装置(固定装置略去)和操作正确的是
| A. |
分离
和水 |
| B. |
酸碱中和滴定 |
| C. |
吸收
尾气 |
| D. |
中和热的测定 |
下列实验操作或装置不符合实验要求的是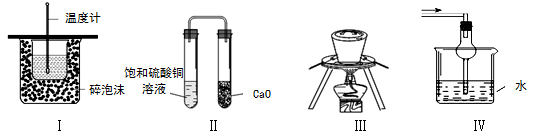
| A.装置Ⅰ可用于测定中和热 |
| B.装置Ⅱ久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C.装置Ⅲ在海带提碘实验中用于灼烧海带 |
| D.装置Ⅳ可用于吸收易溶于水的尾气 |
根据下列热化学方程式:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+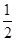 O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH 3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
| A.ΔH =+244.1 kJ/mol | B.ΔH =-488.3 kJ/mol |
| C.ΔH =-996.6 kJ/mol | D.ΔH =+996.6 kJ/mol |
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为
| A.0.15 mol·L-1 | B.0.2 mol·L-1 | C.0.3 mol·L-1 | D.0.4 mol·L-1 |
下列各原子或离子的电子排列式错误的是
| A.Na+ 1s22s22p6 | B.F¯1s22s22p6 | C.N3+ 1s22s22p6 | D.O2¯1s22s22p6 |
下列实验操作或记录正确的是
| A.常温常压下测得1 mol N2的质量为28 g |
| B.用量筒测得排水法收集制得的氢气体积为50.28 mL |
| C.用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液 |
| D.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |