喷泉是一种常见的自然现象,其产生原因是存在压强差。

图1 图2
(1)图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是____
A. HCl和H2O B. O2和H2O C. NH3和H2O D. CO2和NaOH
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶内,分别加入足量下列物质,反应后可能产生喷泉的是__________
A. Cu与稀盐酸 B. NaHCO3与NaOH
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
②在图2的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可以是_______
A. 浓硫酸 B. 食盐 C. 硝酸钾 D. 硫酸铜
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是_______上部烧瓶内气体压强,图2是_______下部锥形瓶内气体压强(均填“增大”或“减小”)
(3)城市中常见的人造喷泉及火山喷发的原理与上述__________(填“图1”或“图2”)装置的原理相似。
等质量的O2和O3所含的分子数之比为____________, 所含原子数之比是_______________.
乙醛的化学性质与甲醛相似,试写出有关乙醛的化学反应方程式,并注明反应类型。
(1) 乙醛与氢气在镍作催化剂,加热条件下的反应
_________________________________________________,________________
(2) 乙醛与新制氢氧化铜悬浊液加热条件下的反应
_______________________________________________,_________________;
(3) 乙醛蒸气在足量氧气中充分燃烧
_______________________________________________,_________________。
A的水溶液可用来浸制生物标本,如果乙醇中含B,饮用后会使人眼睛失明,甚至死亡,D是一种有香味的物质。下面是A、B、C、D 相互转化的关系图,请回答下列各题: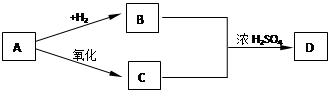
(1)请写出A、B、C、D的结构简式
A____________,B____________,C__________,D____________。
(2)A→B的化学方程式__________________________________,反应类型__________
(3)A→C的化学方程式__________________________________,反应类型__________
(4)生成D的化学方程式________________________________,D的名称_____________
(5)上述物质中能发生银镜反应的有____________,________________,________________。
【选修3:物质结构与性质】
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③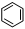 、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ;
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:__________________________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。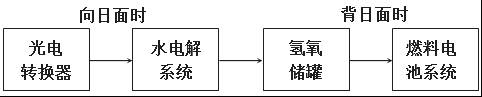
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2, CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:_________________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:_____________________________________________。