在稀酸或稀碱的作用下,一分子醛的α—氢原子(即与—CHO相邻碳原子上的氢)加成到另一分子醛的氧原子上,其余部分加成到羰基碳原子上,生成的产物称为β—羟基醛,这个反应叫做羟醛缩合。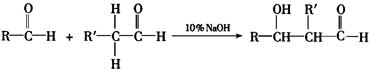
试写出以乙醛为原料制取1—丁醇的化学方程式。 ;
;_________________________________。
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: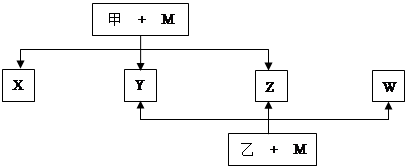
(1)A2D的熔沸点比A2G高的原因是。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是。
(2)E4B3和水反应的化学方程式。
(3)写出M与甲的浓溶液加热时反应的化学方程式。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为;X、Y、W都能与Z反应,则Z的结构式为。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l)△H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为。
据此计算出△H2 =kJ/mol(用含a和b的式子表示)。
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。
请回答下列问题:
(1)b点时,对应含碘物质的化学式为。
(2)b→c过程中,仅有一种元素发生化合价变化, 写出该反应的化学方程式。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为。
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)△H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g)△H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: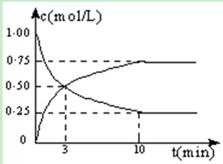
(1)从反应开始到第10min,H2的转化率为,在该条件下,反应的平衡常数K=,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡(选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是(选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
(1)A电极的电极反应方程式为。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是。
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为,Q为(填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g)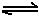 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有性,实验室不能用浓硫酸干燥氨气,说明硫酸具有性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是(填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为。