已知元素的电负性是分子内一个原子吸引电子的能力,能力越大,电负性越大,非金属性越强。电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性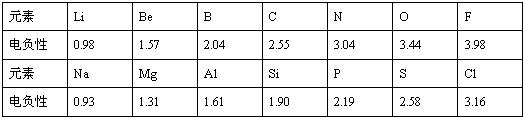
请结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是
(2)预测下列两组元素电负性的大小关系:K Ca ,Na K(填“大于”、“小于”或者“等于”)。
写出下列相应的化学方程式
(1)乙烯→乙醇:(2)丙烯→聚丙烯:
(3)苯→溴苯:(4)苯→环己烷:
从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的结构简式_______,B的分子式_______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式__________,反应类型________。
(3)B与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式_ __________________,反应类型________。
下图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题。
(1)属于烯烃类的有(填编号);
(2)写出化合物B的结构简式,H的分子式__________;
(3)指出上图有机化合物中官能团的名称;
(4)A和C的关系是;
(5)D与G的关系是;
(6)有机物种类繁多的原因有、(至少答两种原因)
现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。
(已知:2CH3CHO+O2 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是;其中③的反应类型是;
⑥的反应类型是;
(2)写乙烯的电子式:乙烯的结构简式:___________ ;
(3)写出下列反应的化学方程式:① _______________ ; ⑤ _______________________________。
(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是,t2~t3速率变化的主要原因是。
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为;②乙元素在周期表中的位置为;③丙元素的最高价氧化物的电子式为;④甲与丁两种元素可组成的具有强氧化性的物质是。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是。