二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴某温度下,SO2(g)+1/2O2(g) SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式:
,现有1L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4L,则混和气体中NO2、NO的物质的量之比为 。
⑶ 硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(未配平)来制取单质I2。NaIO3来源于自然界的矿物。
①NaIO3+NaHSO3—NaI+Na2SO4+H2SO4
②IO3-+I-+H+—I2+H2O
在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时,测得容器内有2molN2,求:
2NH3,反应进行到2min时,测得容器内有2molN2,求:
(1)2min时的N2的浓度?(2)2min内的平均速率υ(NH3)?
(3)反应前后容器中气体压强之比?(4)NH3的分解率?
恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:
2A(g)+B(g) 2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
(1)与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
(2)在另一密闭容器中,通入n(A) molA(g)和n(B)molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有多少摩尔电子通过?(2)Zn片溶解的质量是多少?
(3)原稀H2SO4的物质的量浓度是多少?
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 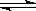 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)求用C来表示的该反应的速率;(2)求反应前A的物质的量浓度;
(3)反应10s后,求B物质的转化率。