实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。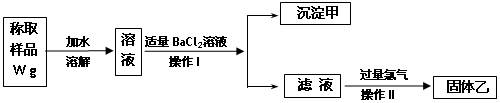
请回答下列问题:
(1)操作I的名称为 ,操作II所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。
某同学设计如下实验方案,以分离KCl 和BaCl2两种固体混合物,试回答下列问题:
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 ,固体B是 。(填化学式)
(3)加入试剂a所发生反应的化学方程式为: 。
加入试剂b所发生反应的化学方程式为: 。
(4)该方案能否达到实验目的: 。若不能,应如何改进(若能,此问不用回答) 。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 的质量。
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验。
Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温后,称重,质量为5.68g。
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入氮气,用40.00mL 1mol•L-1的硫酸溶液吸收产生氨气。蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液。
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的物质全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g。回答下列问题:
(1)在实验I中,不可能用到的实验仪器是________(填正确答案标号)
| A.烧杯 | B.铁架台(带铁圈) | C.坩埚 | D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平 |
(2)在实验Ⅱ中,通入氮气的目的是____________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用______式滴定管;可使用的指示剂为_______;若在滴加氢氧化钠溶液时有少量待测液溅出,会使测量值________。
(4)在实验中,检验沉淀是否洗净的方法是________________。
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为_____________,三颈瓶中发生反应的离子方程式为_________。
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________;实验中应测定的数据有________。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平称取该样品5.000 g,全部溶于水配制成1 000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是___ _____。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL |
0.00 |
12.00 |
18.00 |
22.00 |
23.00 |
23.96 |
24.00 |
24.04 |
25.00 |
26.00 |
30.00 |
| pH |
13.1 |
12.6 |
12.2 |
11.7 |
11.4 |
9.9 |
7.0 |
4.0 |
2.7 |
2.4 |
1.9 |
请在坐标图中绘制出上述中和滴定的曲线。
| 变色范围(pH) |
颜色 |
||
| 酸 |
碱 |
||
| 甲基橙 |
3.1~4.4 |
红 |
黄 |
| 石蕊 |
5.0~8.0 |
红 |
蓝 |
| 酚酞 |
8.2~10.0 |
无 |
红 |

⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
⑥样品中,NaOH的质量百分含量为____________。
(3)以下滴定操作能导致最终滴定结果偏低的是()
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗
化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式为________________。
(2)实验过程中,装置B、C中发生的现象分别是_____________、_____________,这些现象分别说明SO2具有的性质是_________和__________。
(3)尾气可采用__________溶液吸收。
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应: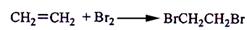 。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题:
。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题: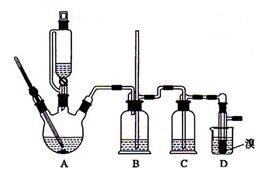
(1)写出装置A中制备乙烯的化学方程式 ;
(2)实验开始要尽可能快地把反应温度提高到170℃,其最主要目的是____(填正确选项前的字母);
A.引发反应 B.加快反应速度 C.防止乙醇挥发D.减少副产物乙醚生成
(3)在装置C中应加入_____ (填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体;
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用_________洗涤除去 (填正确选项前的字母)。
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)装置B的作用有两个,分别是检查实验进行时试管D是否发生堵塞和_____________。