空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为 。
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出亚铁离子的基态电子排布式 。
②CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,CO有多种等电子体,其中常见的两种为 。
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。CaO晶胞如图所示,其中Ca2+的配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO—3 401kJ/mol、NaCl—786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”)。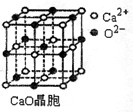
(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5℃),甲醛是“假酒”中的主要有害物质(其沸点是64.65℃),1mol甲醛分子中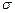 键的数目为 ,甲醇的沸点明显高于甲醛的主要原因是 。
键的数目为 ,甲醇的沸点明显高于甲醛的主要原因是 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)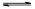 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K=。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为mo1/L 。
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同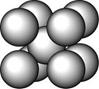

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为, 经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为pm,试解释该晶体原子化热很高的原因。
(已知 ,7.407≈
,7.407≈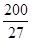 ,1pm=10
,1pm=10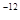 m)
m)
地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如图利用海水得到淡水的方法为。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图。a是电源的极;Ⅰ口排出的是(填“淡水” 或“浓水”)。
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为:___________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:________________________。
(5)离子交换树脂法是制备纯水(去离子水) 的主要方法。某阳离子交换树酯的局部结构可写成(如图)。该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经反应得到的。自来水与该离子交换树脂交换作用后显(填“酸性”、“碱性”或“中性”)。
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大。如果硬度过大,饮用后对人体健康与日常生活有一定影响。暂时硬水的硬度是由(填阴离子符号)引起的,经(填操作名称)后可被去掉。永久硬水的硬度可由离子交换法去掉。
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)下列项目:色度、浊度、pH、某些金属离子、氯离子、硫酸根离子、氮和磷的化合物、、生化需氧量等都是评价水质需要检测的项目,其中生化需氧量主要是检测水体中(填“哪类物质”)消耗氧气的量。
(2)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(3)下图是某市污水处理的工艺流程示意图:
① 下列物质中不可以作为混凝剂(沉降剂)使用的是(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是(填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(4)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→ 口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯g。
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:。(未说明原因不给分)
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如图所示,其分子内不含有(填字母)。
A.离子键 B.共价键 C.配位键 D.氢键