有一种广泛应用于汽车、家电产品上的高分子涂料,是按下列流程生产的,图中的M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
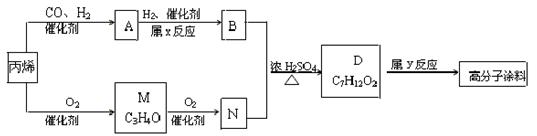
试写出:
(1)物质的结构简式:A ,M ;物质A的同类别的同分异构体为 。 (2)N+B D的化学方程式 。
(2)N+B D的化学方程式 。
(3)反应类型:x ,y: 。
同学们吃的零食的包装袋中经常有一个小纸带,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是(用化学方程式表示)______________________________。
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸带中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?举出一例。
在一定条件下,RO3 n-和 I-发生的离子方程式如下:
RO3 n-+ 6I- + 6H+ ="=" R- + 3I2 + 3H2O
(1)RO3n-中R元素的化合价是_____________
(2)R元素的原子最外层电子数是________。


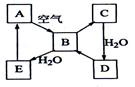
 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。 (1)写出A在加热条件下与H2反应的化学方程式
(1)写出A在加热条件下与H2反应的化学方程式 _________________________________________________。
_________________________________________________。 (2)写出E与A的氢化物反应生成A的化学方程式 。
(2)写出E与A的氢化物反应生成A的化学方程式 。 (3)写出一个由D生成B的化学方程式 ______________________。
(3)写出一个由D生成B的化学方程式 ______________________。 (4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。 ①写出反应的离子方程式________________________;
①写出反应的离子方程式________________________; ②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________; ③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家,大气中的臭氧层可滤除大量的紫外线,保护地球上的生物,氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3),有关反应为: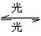

 O3O2+OCl+O3====ClO+O2ClO+O====Cl+O2
O3O2+OCl+O3====ClO+O2ClO+O====Cl+O2

 总反应:2O3====3O2
总反应:2O3====3O2 (1)在上述臭氧变成氧气的反应过程中,Cl是
(1)在上述臭氧变成氧气的反应过程中,Cl是
| A.反应物 | B.生成物 | C.中间产物 | D.催化剂 |
 (2)O2和O3之间的关系是 。
(2)O2和O3之间的关系是 。
臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。