已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
0.01 mol·L-1AgNO3溶液,下列叙述正确是( )
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中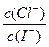 约为1.02×103 约为1.02×103 |
下列叙述正确的是
| A.环丙烷是饱和烃,不能使酸性高锰酸钾溶液褪色 |
| B.乙醇可直接被酸性重铬酸钾溶液氧化 |
| C.氧元素是宇宙中最丰富的元素 |
| D.金属Mg只能用电解法制取 |
有机物A可以发生下列反应:已知C能发生银镜反应,E不发生 银镜反应。则A的可能结构有
银镜反应。则A的可能结构有
| A.1种 | B.2种 | C.3种 | D.4种 |
某无色溶液,由Na+、Ca2+、Al3+、Cu2+、 、
、 、
、 、
、 中的若干种组成。取适量该溶液进行如下实验:①加入过量盐酸,有无色、无味气体X生成;②在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液并加热,有刺激性气味的气体Y生成,并析出白色沉淀乙。则下列判断正确的是
中的若干种组成。取适量该溶液进行如下实验:①加入过量盐酸,有无色、无味气体X生成;②在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液并加热,有刺激性气味的气体Y生成,并析出白色沉淀乙。则下列判断正确的是
A.原溶液中一定存在的离子是Na+、 、 、 |
B.原溶液中一定存在的离子是Al3+、 、 、 |
| C.白色沉淀甲为Al(OH)3、乙为BaSO4 |
| D.气体X为CO2、气体Y为SO2 |
工业上生产MnO2和Zn的主要反应有:
①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法正确的是
MnO2+Zn+2H2SO4下列说法正确的是
| A.①中MnO2和H2SO4都是氧化剂 | B.①中析出32gS时转移1mol电子 |
| C.②中MnSO4发生氧化反应 | D.②中生成的Zn在阳极析出 |
下列说法不正确的是
| A.云、烟、雾等均能产生丁达尔现象 |
| B.开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径 |
| C.用脱硫处理的煤代替原煤做燃料可以有效减少空气中CO2气体的含量 |
| D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |