右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )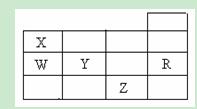
A.常压下五种元素的单质中, Z单质的沸点最高 Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
加热NH4HCO3固体,使产生的气体依次通过盛有过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气体是( )
| A.O2 | B.NH3 | C.CO2 | D.CO2和O2 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 =K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
| A.生成40.0LN2(标准状况) | B.有0.250molKNO3被氧化 |
| C.转移电子的物质的量为1.25mol | D.被氧化的N原子的物质的量为3.5mol |
往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是
①一定存在Mg2+;②可能存在CO32-;③一定存在Cl-;④可能存在Ba2+;⑤可能存在Mg2+
| A.①③ | B.②③ | C.③⑤ | D.④⑤ |
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |