A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产中的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。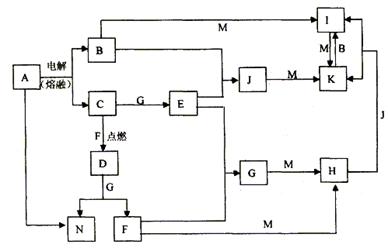
回答下列问题:
(1)H的化学式为________________________,D的电子式为_____________。
(2)工业上用A制取N反应的化学方程式为:____________________________________。
(3)I的饱和溶液滴入沸水中反应的离子方程式为:______________________ _______。
(4)G与M反应的化学方程式为_____________________________________ _______。
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是:
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
(2)氯化铝水溶液呈性 ,其离子方程式表示为;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是
。
(2)25℃ 下,将pH=13的氢氧化钠溶液与pH=1的稀盐酸等体积混合,所得混合溶液的pH=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性(填“酸”、 “中”或“碱”),溶液中c(Na+)c(CH3COO-)[填“>”、“=”或“<”] 。
(1)在25℃、101kPa下,16g甲烷燃烧生成CO2和液态水时放热889.6kJ。则表示甲烷燃烧的热化学方程式为_________________________________________________。
(2) 下列说法正确的是(填序号)____:(漏选得1分,错选、多选得0分)
| A.相同温度下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大; |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
D.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 |
离平衡;
E. 除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比
MgCO3的大;
下表是不同温度下水的离子积数据:
| 温度 / ℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是________________________________________________________。
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关
系正确的是______________
A.c(Na+)>c(HCO )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO )
)
B.c(Na+)+c(H+)=c(HCO )+c(CO
)+c(CO )+c(OH-)
)+c(OH-)
C.c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(HCO )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K=。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。