已知乙烯能发生以下转化: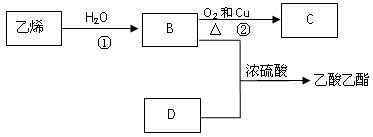
(1)乙烯的结构简式为:
(2)图中浓硫酸所起作用是______________________
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
已知反应:①酸X+碱Y→NaCl+水;②碱Y+盐W→NaCl+难溶性碱;③盐Z+盐H→NaCl+难溶性盐。则
(1)X的名称是;Y的化学式是。
(2)盐W中一定含有元素。
(3)写出盐Z和盐H反应的化学方程式:。
制备AgI胶体的做法是:取一支大试管,注入0.01 mol/L KI溶液10mL,用胶头滴管滴入8~10滴相同浓度的AgNO3溶液,边滴入边振荡。KI+AgNO3=AgI(胶体)+KNO3
简要回答下列问题:
(1)为什么要用稀的KI溶液和稀的AgNO3溶液?
____________________________________。
(2)为什么要缓慢地滴加AgNO3溶液于KI溶液中?并且还要边振荡?____________________________________。
在Cu(NO3)2和AgNO3的混合溶液中加入一定量的锌粉,使之充分反应后,有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是。
(2)若反应后过滤,向所得固体物质加盐酸没有气体产生。则溶液中一定有,可能有。
(3)若反应后过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则此时溶液中含有的溶质为。
写出下列物质的化学式,并进行物质的分类(按单质、酸性氧化物、碱性氧化物、酸、碱、正盐、酸式盐、碱式盐)。
(1)磷酸、;(2)纯碱、;
(3)铜绿、;(4)小苏打、;
(5)硝酸亚铁、; (6)氩、。
有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液.现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙液中,先出现凝聚,后液体变清,则甲为 ,乙为 ,丙为 ,丁为 。