A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C 相邻,C的最外层电子数是其电子总数的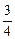 ,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中,沸点最高的是(用化学式表示,下同)_____________,稳定性由强到弱的顺序是___________________________________。
(2)若由A、B、C、D四种元素组成一种离子化合物,1 mol该化合物中含有10 mol原子,则该化合物受热分解的化学方程式为:___________ 。
若由A、B、 C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
(3)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1 mol NaNO2发生反应时,共有3 mol电子转移,该反应的化学方程式为_________________________。
工业合成氨N2+3H2 2NH3反应过程中的能量变化如下图所示,据图回答下列问题:
2NH3反应过程中的能量变化如下图所示,据图回答下列问题:
(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低__________,理由是________________________________________________________________________。
(2)该反应平衡常数表达式为:K=__________,当浓度商Qc__________K(填“<”、“>”或“=”)时,反应向右进行。
(3)450℃时该反应的平衡常数__________500℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有__________(填字母代号)。
a.高温高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3
I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2 N2O4 ΔH=-57 kJ/mol,
N2O4 ΔH=-57 kJ/mol,
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是;
②一段时间后气体颜色又变浅的原因是
③在此过程中,该反应的化学平衡常数将(填“增大”、“减小”或“不变”,下同)NO2的转化率将。
在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:
2A(g)+B(g) 3C(g)。
3C(g)。
已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是______(用含a的代数式表示)。
(2)在相同的实验条件下,若在同一容器中改为加入2 mol A 和4 mol B,达到平衡后,C的物质的量为______mol(用含a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比________(填“增大”、“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气中的体积分数仍与原平衡相同,则还应加入________ mol C。
(1)已知0.5 mol CH4(g)与0.5 mol 水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是
________________________________________________________________________。
(2)已知下列热化学方程式
Zn(s)+ O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
Hg(l)+ O2(g)===HgO(s) ΔH2=-Q2 kJ/mol②
O2(g)===HgO(s) ΔH2=-Q2 kJ/mol②
Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH3=-Q3 kJ/mol③
则Q3与Q1和Q2的关系式为:Q3=________。
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的
资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,
在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=;
(2)该反应的平衡常数表达式K=;
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分);
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是(填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)