(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试 纸检验Cl2的性质 ;
纸检验Cl2的性质 ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 (多选倒扣分)
| A.用碱式滴定管量取25.00mL溴水 |
| B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
(3)卤素单质F2、Cl2、Br2、I2的熔沸点由高到低排列为 ,理由是 ;
卤化氢HF、HCl、HBr、HI中,沸点最低为 ,最高为 ,造成的原因为 。
图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上
一氯取代位置有三种。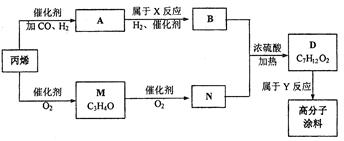
(1)试写出下列物质的结构简式:A M
(2)写出反应N+B D的化学方程式:
D的化学方程式:
(3)写出反应类型:x ,Y
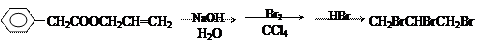
(1)写出以上有机物转化过程中各步反应的化学方程式
第一步:
第二步:
第三步:
(2)写出CH2BrCHBrCH2Br的所有同分异构体的结构简式
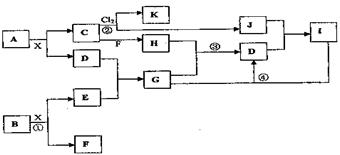
请按要求回答:
(1)写出A的化学式H的电子式
(2)反应①中每生成l mol F,转移电子的物质的量为
(3)反应②进行的条件为
(4)反应③的化学方程式为
(5)反应④的离子方程式为
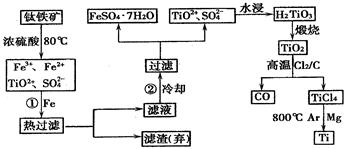
(1) Fe的原子序数为26,Fe位于元素周期表中第周期,第族
(2) 步骤①加铁粉的目的是
步骤②冷却的目的是
(3) 上述过程中,可以利用的副产物是
(4) 写出TiO2、Cl2、C在高温下发生反应的化学方程式
(5) 反应TiCl4+2Mg 2MgCl2+Ti ,在Ar气体中进行的目的是
2MgCl2+Ti ,在Ar气体中进行的目的是
常温常压下,A、B、C、D均为气体。A与B可发生可逆反应:A+B C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
| 温度/℃ |
压强/Pa |
C平衡浓度/mol·L-1 |
| 25 |
1×105 |
1.0 |
| 25 |
2×105 |
1.8 |
| 25 |
3×105 |
3.2 |
| 25 |
4×105 |
6.0 |
(1)该可逆反应中化学计量数n的取值范围为__________,理由是______________。
(2)在5×105 Pa时,D的状态为______________。