(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
中学课本中常见的几种气体:①O2②H2③CO2④Cl2⑤H2S ⑥SO2⑦NH3都要求掌握其实验室制法。根据所学知识回答有关问题(填气体编号)
(1)能用启普发生器制备的气体有。
(2)能用浓H2SO4干燥的气体有。
(3)能用碱石灰干燥的气体有。
(4)收集气体的方法常有:排水法、向上排空气法和向下排空气法。如下图,用仪器A、B和橡胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外,不能选用其它试剂)正确的操作步骤是。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。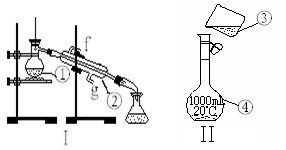
⑴写出下列仪器的名称:
①;②。
⑵仪器①~④中,使用时必须检查是否漏水的有。(填序号)
⑶若利用装置I制取蒸馏水,还缺少的仪器有,将 仪器补充完整后进行的实验操
仪器补充完整后进行的实验操 作的名称为:,冷却水从口进。
作的名称为:,冷却水从口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是, 。
。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从色变为色,且半分钟不变色。
(4)如图是某次滴定时的滴定管中的液面,其读数为ml
(5)根据下列数据:请计算待测盐酸溶液的浓度:
| 滴定次数 |
待测体积(ml) |
标准烧碱体积(ml) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室 有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度____________。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题: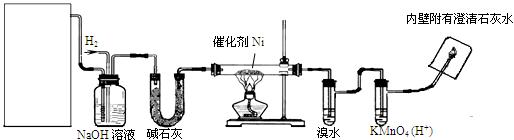
(1)方框内装置用来制取乙烯,其中包括的仪器是:①碎瓷片②石棉网和铁架台
③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞
⑧双孔塞⑨导管。不选用的仪器有(填序号)
(2)写出实验室制乙烯化学方程式:
(3)碱石灰的作用是:________________________________________________
(4)实验过程中,发现溴水会褪色,可能的原因是:_____________________________
(5)出现什么现象可说明生成了乙烷?________________________________________