掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。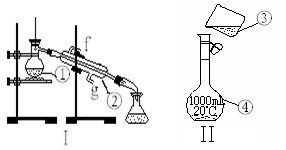
⑴写出下列仪器的名称:
① ;② 。
⑵仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
⑶若利用装置I制取蒸馏水,还缺少的仪器有 ,将 仪器补充完整后进行的实验操
仪器补充完整后进行的实验操 作的名称为: ,冷却水从 口进。
作的名称为: ,冷却水从 口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 ,  。
。
某研究性学习小组对还原铁粉与水蒸气的反应的产物进行科学探究,已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃;根据下图所示实验装置,进行了还原铁粉与水蒸气反应的实验,实验中观察到肥皂液中产生大量气泡。
(1)实验中Ca(OH)2的作用是_____________,实验中的气体产物是
(2)为进一步探究还原铁粉与水蒸气反应产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体(纯净物)。针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:____________________________________________________
I、限选用下列试剂:盐酸、KSCN溶液、K3[Fe(CN)6]溶液、氯水证明假设一不成立。
其操作和现象为:
II、为了进一步确定产物的成分,用黑色固体进行了下列实验:
①加入足量氯水所发生反应的离子方程式是___________________________________________;
②灼烧时盛放固体的仪器是 _____________;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是_____________g。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2 2KMnO4+MnO2↓+2K2CO3
2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度g/100g |
111 |
33.7 |
11.1 |
6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和。(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
加酸时不宜用硫酸的原因是:;不宜用盐酸的原因是( )
(2)K2MnO4的转化2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
(3)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知 涉及到的反应:Na2C2O4+ H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+ 2MnO4—+6H+→2Mn2++10CO2↑+ 8H2O
Ⅰ 称取0.80 g的高锰酸钾产品,配成50 mL溶液。
Ⅱ 称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为(保留3位小数)。达到滴定终点的标志是。
(4)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度。(填“偏高”、“偏低”或“无影响”)
(5)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,
其原因可能为。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数。
写出探究②中出现的所有离子反应方程式。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是。
(4)分析Y气体中的Q2气体是如何生成的。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
a.A之前 b.A-B间 c.B-C间d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是。
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
填写下列空白:(注:溴苯与NaOH溶液不反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式)_____________。
(2)试管C中苯的作用是________;反应开始后,观察D和E试管,看到的现象为D中_________ ;E中;
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是。
(4)在上述整套装置中,具有防倒吸的仪器有_______(填字母)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是_______________。
酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的化学方程式为:_____________________。
(2)欲提高乙酸的转化率,可采取的措施有__________________________________、
_____________________________________________等。
(3)若用下图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:___________、
__________________。
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:。
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.7 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
①根据表中数据,下列________(填编号),为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能是_________________。