欲在室温和1.01×105 Pa条件下测定镁的相对原子质量。请利用下图给定的仪器中选择合适的仪器组成一套实验装置(每仪器只允许用一次)。
请回答下列问题:
(1)假设气流方向为左→右,则所选各仪器的接口连接顺序为(用小写字母填写):
_________________________________。
(2)连接好仪器后,要进行的操作有以下几步:
①待反应容器中的物质恢复至室温时,测量出气体体积折合到标准状况下为V mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g);
③检查各装置的气密性;
④往反应容器内加入某稀酸,至镁条不再溶解。
上述几步操作的先后顺序是 。
(3)根据实验数据可算出镁的相对原子质量,其数学表达式为____________________。
(4)若未将反应容器冷却至室温就测量气体体积,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)_______________。
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)__________________。
有关含氮化合物的性质实验
(一)某研究性学习小组利用图一装置研究硝酸的性质。实验一、甲同学用下图一装置来证实稀硝酸与铜反应生成NO。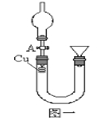
(1)从A中向U形管中注满稀硝酸后,发生的现象。
(2)以下收集NO气体的各种装置中,合理的是。(填序号,多选不给分)
(3)在100 mL 混合溶液中, HNO3和 H2SO4的物质的量浓度分别是 0.4 mol/L, 0.1 mol/L 向该混合液中加入1.92 g铜粉,加热待充分反应后,所得溶液中 Cu2+的物质的量浓度是。
实验二、乙组同学利用上述装置完成浓硝酸与铜的反应
(4)乙组同学发现实验室里有几瓶浓硝酸呈黄色,请用化学方程式和简单的文字说明解释这种现象。
(5)同学们发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了NO2气体所致。同学们分别设计了以下4个实验来判断两种看法是否正确。
这些方案中可行的是。(填序号,多选不给分)
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化
④向饱和硝酸铜溶液中通入NO2气体,观察颜色变化
(二)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
(6)写出三位同学实验装置制取氨气原理的化学方程式:。
(7)检验氨气是否收集满的方法是(简述操作方法、现象和结论)。
某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。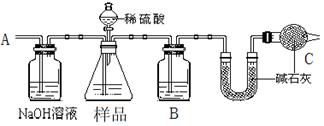
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是。
(2)从导管A处缓缓鼓入一定量的空气的目的是。
(3)该样品中NaHCO3的质量分数为。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是。
亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=== 2NO2-+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃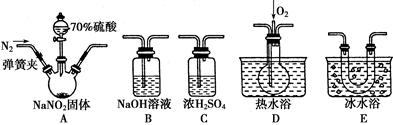
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,目的是______________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是______________________________。
②装置E的作用是__________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的离子反应方程式为____________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________________。
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,______________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。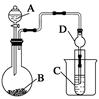
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水b.NaOH溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a.A之前b.A-B间c.B-C间d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。