0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.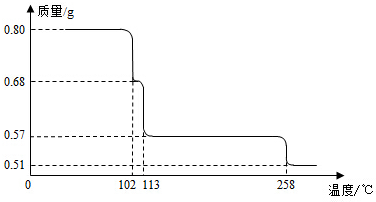
请回答下列问题:
(1)试确定200℃时固体物质的化学式___________________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为____________________________________________;
(4)若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是__________________mol•L-1(溶液体积变化可忽略不计)。
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于刚才镀铝。工艺流程如下: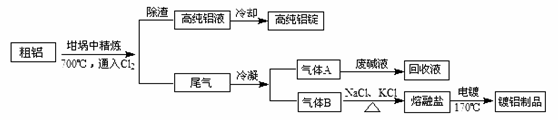
(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理A的过程中,所发生反应的例子方程式为 、______________。
(4)钢材镀铝后能防止钢材腐蚀,其原因是
(5)铝与过量NaOH溶液反应的离子方程式为________________________。反应后溶液中通入过量CO2,所发生反应的离子方程式为__________________________。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ="===" 3Fe2+ 2TiO2+(无色)+ Fe + 4H+="===" 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ====TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在_________范围。
(3)写出④中TiO2和焦炭、氯气反应的化学方程式:______________________________。
(4)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(5)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图_____________________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素完全氧化,剩余的I2用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应,生成物之一可以用淀粉溶液检验。根据反应溶液出现蓝色所需的时间来衡量该反应的速率,写出该反应的离子方程式为________________________。
[化学——选修3:物质结构与性质]
碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态14C原子中,核外存在_______________对自旋相反的电子;
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 、C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
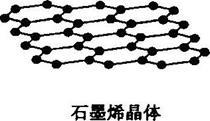
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。