有A、B、C、D、E、F六种前四周期元素,原子序数A<B<C<D<E<F。A原子只有一个电子层且只含1个电子;B、C两元素的基态原子具有相同能级,且I1(B)>I1(C),其中基态B原子的2p轨道上有3个未成对电子;D原子s电子数比p电子数少4;E原子的3p轨道上得到1个电子后不能再容纳外来电子;F为周期表前四周期中电负性最小的元素
(1)写出下列元素的元素符号:下
C___________ F_____________
(2)写出E元素原子的价电子轨道表示式___________________
(3)B、C两元素原子的电负性大小: B_______C(填“<”或“>”)
(4)A2C与A2D的熔沸点:A2C_______A2D (填“<”或“>”)
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为_____________
(6)BA3的中心原子杂化方式为______杂化,该化合物的空间构型为_____________.
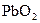 是很强的氧化剂,在酸性溶液中它可将
是很强的氧化剂,在酸性溶液中它可将 氧化成
氧化成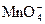 。取1支试管,加入少量
。取1支试管,加入少量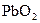 固体和2mL6 mol
固体和2mL6 mol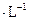
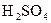 ,然后滴入2mL1 mol
,然后滴入2mL1 mol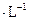
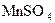 溶液。试回答:
溶液。试回答:
(1)搅拌后,溶液的颜色变化是_____________________________
(2)反应的化学方程式是___________,硫酸的作用是________________
(3)能否用盐酸代替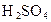 ________(填“能”或“不能”),用化学方程式回答
________(填“能”或“不能”),用化学方程式回答
_______________
两种非金属元素x、Y在元素周期表中彼此相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:Xm+Yn+H2O→HY+H3XO4+XH4Y(未配平)。(m、n均为大于l的正整数)
(1)若xmYn在常温下均为常见固体,则Xm是__________,Yn是__________;(填化学式)
(2)试根据推断后,完成(配平)上述化学方程式_____________________
(3)试解释下列两反应能进行的原因: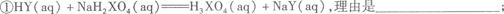
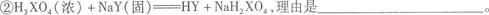
X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X → A(g), Y+Z → B(g)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
① Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
① B的化学式是;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
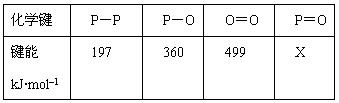
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=kJ·mol–1。
如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如图转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体,试推断:
①X的电子式是_______________,若丙为灰黑色固体,则其晶体类型为_________________(填分子晶体,原子晶体,混合型晶体)。
②工业上有些气体中也含有一定量的Z成分,试列举一种气体______________。
③X与甲反应的化学方程式__________________________。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式甲____________、乙____________、丙____________。
②写出X与足量的甲在溶液中完全反应的离子方程式:。