水的电离平衡曲线如图所示。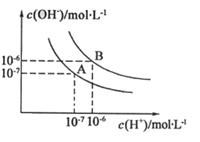
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从 变化到 。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为 。
(3)已知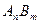 的离子积为
的离子积为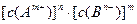 若某温度下
若某温度下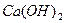 的溶解度为0.74g,设饱和溶液的密度为
的溶解度为0.74g,设饱和溶液的密度为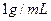 ,其离子积约为 。
,其离子积约为 。
(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为 。
(8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。
(2)利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。
该反应的化学平衡常数表达式为K=,该反应ΔS0(填“>”或“ <”),若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、“向右”或“不”)。20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是(填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为。
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1 H2C2O4溶液 |
30 mL 0.01 mol·L-1 KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1 H2C2O4溶液 |
30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)写出草酸溶于水的电离方程式:。
(2)该实验探究的是因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:①②(填:>、<、=)。
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则 在2 min末, c(MnO4-)=mol/L。
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率。
(5)小组同学发现反应速率随时间变化如图所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热,②。
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式:。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。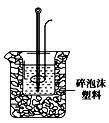
①实验时所需的玻璃仪器除烧杯、量筒外还需:。
②该装置中有一处错误是:,如果用该错误装置测定,结果会(填“偏高”“偏低”“无影响”)
③如果该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是:。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为次。使用正确的装置进行实验,取上述溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是。
a高温高压 b低温低压 c减少CO2的浓度
d增加CO的浓度e分离出二甲醚f加入催化剂
(4)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v(正)v(逆)(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)=。