在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中,(如右图):容器中发生以下的反应:
N2(g)+3 H2(g)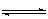 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向 方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是 。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是
有如下图所示六组制取漂白粉的装置,请依据题意回答问题。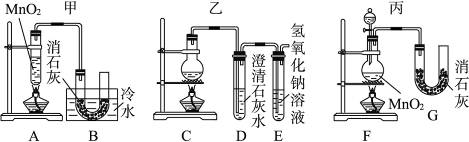
(1)有下列几项优缺点:a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。请对上图所示的甲、乙、丙三套装置的优缺点作出评析,选择符合题目要求的选项填在下列空格内。
| 优点 |
缺点 |
|
| ①甲装置 |
||
| ②乙装置 |
||
| ③丙装置 |
(2)上图所示装置中,甲由A、B两部分组成;乙由C、D、E三部分组成;丙由F、G两部分组成。请从图A~G各部分装置中选取合理的组成部分,组装成一套较完善的实验装置,装置的连接顺序(按气流从左到右的方向)是__________。
(3)实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________(填“大于”“小于”或“等于”)0.15 mol,其原因是(假定各步反应均无反应物损耗,且用无副反应发生)________________________________________。
某学习小组用如右图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。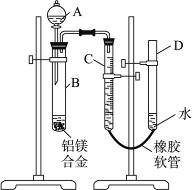
(1)A中试剂为__________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是__________(填序号);记录C的液面位置时,除视线平视外,还应__________。
(4)B中发生反应的化学方程式为____________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为__________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将__________(填“偏大”“偏小”或“不受影响”)。
已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol·L-1硫酸、2 mol·L-1硝酸、2 mol·L-1 NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有__________元素;
假设2:该混合金属粉末中除铝外还含有__________元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素。
(2)设计实验方案
基于假设3,设计出实验方案
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
某待测溶液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、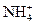 、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
根据实验结果:
(1)判断待测液中有无Ba2+、Ca2+,并写出理由____________________。
(2)写出沉淀D的化学式__________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:____________________。
某同学用比色法测定标准含铁量100 mg/片的抗贫血药片剂。已知实验室有以下仪器:100 mL容量瓶、500 mL容量瓶、酸式滴定管、碱式滴定管,其他仪器任选,1×10-3 mol·L-1 Fe3+标准溶液,其他试剂若干。
(1)补血剂中铁元素均为亚铁化合物,而不用三价铁的化合物,这是因为__________。
| A.Fe3+易水解生成Fe(OH)3,不利于吸收 |
| B.Fe3+易被还原成Fe2+,不便于在空气中保存 |
| C.Fe3+有强氧化性,对人体有腐蚀、刺激作用 |
| D.三价铁有毒 |
(2)比色实验必须用到的专用仪器是;
实验前必须检漏的仪器是__________;
必须用待装液润洗的仪器是__________;
取用Fe3+标准液要选__________滴定管。
(3)Fe3+易水解,使溶液显__________性,溶液越稀Fe3+的水解百分比越__________,因此要加入__________溶液调节pH。
(4)该同学分别取1 mL、2 mL、4 mL、8 mL标准Fe3+溶液配制成25 mL标准色阶,并标号为1、2、3、4。为便于与标准色阶比较,如用1片该药品配制待测液,应选用__________mL容量瓶,溶解药片时,先加少量水溶解,再加入2 mL 1∶1 HNO3,并加盐,目的是____________________。该同学发现待测液与色阶3颜色最接近,该药品的铁元素含量是否达到3标准值?__________(填“是”或“否”)。