过氧 化氢对环境友好,性质多样,有很重要的研究和应用价值。
化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积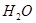
 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号] |
条件 |
现象 |
结论 |
|
| 温度/℃ |
催化剂 |
|||
| 1 |
40 |
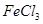 溶液 溶液 |
|
|
| 2 |
20 |
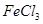 溶液 溶液 |
|
|
| 3 |
20 |
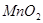 |
|
|
| 4 |
20 |
无 |
|
|
实验1、2研究的是______________对 分解速率的影响。
分解速率的影响。
实验2、3的目的是____________________________。
实验中可以表明该反应速率差异的现象是______________。
②实验室用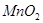 做该反应的催化剂,使用如下图所示装置的A部分制备
做该反应的催化剂,使用如下图所示装置的A部分制备 ,避免反应过于剧烈的操作是______________。
,避免反应过于剧烈的操作是______________。
(2) 与水反应也可生成
与水反应也可生成 ,某同学取
,某同学取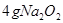 样品与过量水反应,待反应完全终止时,得
样品与过量水反应,待反应完全终止时,得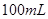 溶液X和
溶液X和 (已折算为标准状况),该同学推测样品中含有杂质或反应中生成
(已折算为标准状况),该同学推测样品中含有杂质或反应中生成 ,并进行实验研究。
,并进行实验研究。
①取少量X于试管中,滴加 溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。
溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。
②通过如上图所示整套实验装置测定 样品的纯度,假设所含杂质不参加反应,取25
样品的纯度,假设所含杂质不参加反应,取25 ,滴入烧瓶内使其与过量
,滴入烧瓶内使其与过量 酸性溶液反应,最终生成
酸性溶液反应,最终生成 (已折算为标准状况),则此样品中
(已折算为标准状况),则此样品中 的质量分数是____________________________。
的质量分数是____________________________。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,直到因加入一滴盐酸后,溶液由 色变为 色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,终点读数为_____mL,所用盐酸溶液的体积为_____mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
(19分) 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是__ __,发生反应的离子方程式为________。加高锰酸钾溶液前,若pH较低,对除杂的影响是_________。
(2)反应③的反应类型为___________,过滤得到的滤渣中,除了过量的锌外还有__________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是_________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1 g.则x等于 _________。
(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。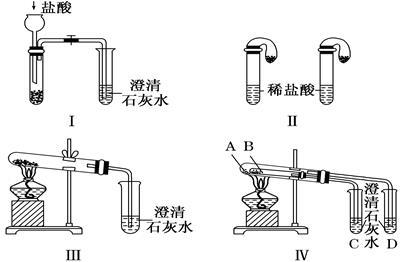
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:_________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______(填化学式)。
(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/mol·L-1 |
V(Na2S2O3)/mL |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
V(H2O)/mL |
| ① |
25 |
0.1 |
5.0 |
0.1 |
10.0 |
a |
| ② |
25 |
0.1 |
10.0 |
0.1 |
10.0 |
0 |
| ③ |
25 |
0.2 |
5.0 |
0.1 |
5.0 |
b |
| ④ |
50 |
0.2 |
5.0 |
0.1 |
10.0 |
5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验 (填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为 和 。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
实验操作①中测试时pH试纸的颜色应该接近 。
A.红色B.黄色C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的 性。
(10)实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
c(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。